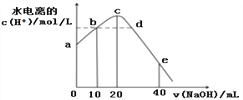
题目内容
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.金属和一定量的任意酸反应,只要放出2 g氢气,则转移的电子数为2NA
B.100 g 46%的乙醇水溶液中,含O—H键的数目为NA
C.48 g正丁烷和10 g异丁烷的混合物中共价键数目为11NA
D.含0.3 mol NH4NO3与a mol NH3·H2O的中性溶液中含0.3NA个NH![]()
【答案】D
【解析】
A.若一定量的浓硫酸和金属反应,开始时产生二氧化硫,当浓硫酸变稀后才生成氢气,此时放出2g氢气时,转移的电子数不是2NA,故A错误;
B.100 g 46%的乙醇水溶液中乙醇的质量为为46g,物质的量为1mol;水的质量为54g,物质的量为3mol; 1mol乙醇所含O—H键的数目为NA,但3mol水中还有6molO—H键,故B错误;
C.正丁烷和异丁烷的摩尔质量均为58g/mol,故48 g正丁烷和10 g异丁烷的混合物即共58g混合物的物质的量为1mol,且两者结构中均含13个共价键,故1mol混合物中含共价键为13NA,故C错误;
D.溶液中存在电荷守恒c(NH![]() )+c(H+)= c(NO
)+c(H+)= c(NO![]() )+c(OHˉ),溶液显中性,所以c(H+)= c(OHˉ),则c(NH
)+c(OHˉ),溶液显中性,所以c(H+)= c(OHˉ),则c(NH![]() )= c(NO
)= c(NO![]() ),即n(NH
),即n(NH![]() )= n(NO
)= n(NO![]() ),0.3 mol NH4NO3中n(NO
),0.3 mol NH4NO3中n(NO![]() )=0.3mol,所以溶液中n(NH
)=0.3mol,所以溶液中n(NH![]() )=0.3mol,即0.3NA,故D正确;
)=0.3mol,即0.3NA,故D正确;
故答案为D。

【题目】900 ℃时,向2.0 L恒容密闭容器中充入0.40 mol乙苯,发生反应:
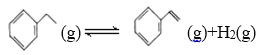
一段时间后,反应达到平衡,反应过程中测定的部分数据如下表所示:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
下列说法正确的是
A.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率大于50.0%
B.反应在前20 min内的平均反应速率v(H2)=0.008 mol·L-1·min-1
C.保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,体系的总压增大,平衡时苯乙烷的分压也增加。
D.相同温度下,起始时向容器中充入0.10 mol乙苯、0.10 mol苯乙烯和0.30 mol H2,则达到平衡前:v正<v逆