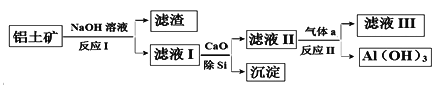
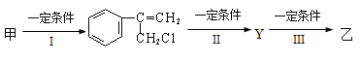
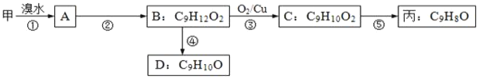
题目内容
【题目】5.6 g铁粉投入到足量的100 mL 2 mol·L1的稀硫酸中,2 min时铁粉刚好溶解,下列表示这个反应的速率正确的是
A.v(Fe)=0.5 mol·L1·min1B.v(H2SO4)=1 mol·L1·min1
C.v(H2SO4)=0.5 mol·L1·min1D.v(FeSO4)=1 mol·L1·min1
【答案】C
【解析】
A.Fe为纯固体,不能用浓度变化量表示反应速率,故A错误;
B.Fe为物质的量![]() =0.1mol,由Fe+H2SO4=FeSO4+H2↑,可知参加反应的硫酸也是0.1mol,硫酸的浓度变化量为:
=0.1mol,由Fe+H2SO4=FeSO4+H2↑,可知参加反应的硫酸也是0.1mol,硫酸的浓度变化量为:![]() =1mol/L,故v(H2SO4)=
=1mol/L,故v(H2SO4)=![]() =0.5 mol/(Lmin),故B错误;
=0.5 mol/(Lmin),故B错误;
C.由B中计算可知:v(H2SO4)=0.5 mol/(Lmin),故C正确;
D.化学反应速率之比等于化学计量数之比,则v(FeSO4)=v(H2SO4)=0.5 mol/(Lmin),故D错误;
故答案为C。

练习册系列答案
相关题目