题目内容
【题目】过氧化钙主要用作杀菌剂、防腐剂等,温度在350℃以上容易分解。某同学在实验室中利用纯氧制取少量CaO2,其装置示意图如图:
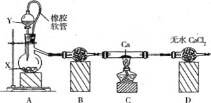
回答下列问题:
(1)制备氧气的方法有多种,若X是MnO2,则Y 是____,若Y是H2O,则A中反应的化学方程式为__。
(2)使用橡皮软管的好处是_____, B中试剂是______.
(3)实验结束时,该同学取少量C中固体置于水中,发现有一种刺激性气味的气体且该气体遇石蕊试液变蓝色,则该气体成分是_______。
(4)为测量产品的纯度,该同学准确称量8.00g产品,然后溶解在足量的KI酸性溶液中,充分反应后再取上述溶液总量的一半,用0.2000 mol·L-1Na2S2O3溶液滴定(I2+2Na2S2O3 =2NaI+Na2S4O6,指示剂为淀粉),滴定终点时消耗了VmL标准溶液。判断滴定 达到终点时的依据是__________,产品中CaO2纯度为________%。
【答案】H2O2 2Na2O2+2H2O=4NaOH+O2↑ 平衡压强,使分液漏斗中的液体顺利滴下 无水CaCl2或碱石灰 NH3 溶液蓝色消失且在30s内不恢复蓝色 0.18V
【解析】
(1)装置A用于制备氧气,当X是MnO2时,Y是H2O2;当Y是水时,X是Na2O2;
(2)平衡压强,使分液漏斗中的液体顺利滴下;由于过氧化物易与水反应,故装置B是干燥装置;
(3) Ca可能会和空气中氮气生成氮化钙,氮化钙溶于水产生氨气,由气体性质知其是NH3;(4)酸性溶液中CaO2将KI氧化为I2,滴定中I2又被还原为I-。
(1)装置A用于制备氧气,当X是MnO2时,Y是H2O2;当Y是水时,X是Na2O2;
(2)橡胶软管可将分液漏斗与烧瓶连接起来,从而可以平衡压强,使分液漏斗中的液体顺利滴下;由于过氧化物易与水反应,故装置B是干燥装置,试剂为无水CaCl2或碱石灰;
(3) Ca可能会和空气中氮气生成氮化钙,氮化钙溶于水产生氨气,由气体性质知其是NH3;(4)酸性溶液中CaO2将KI氧化为I2,滴定中I2又被还原为I-,终点颜色变化为溶液蓝色消失且在30 s内不恢复蓝色。由前面的分析知,CaO2~I2~2Na2S2O3。故4.00 g样品中n(CaO2)=1×10-4V mol,质量为0.0072V g,质量分数为0.18V%。