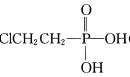
题目内容
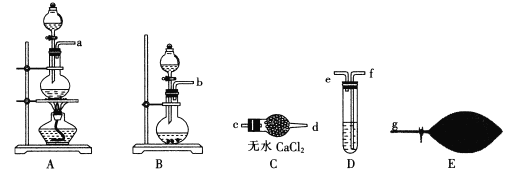
【题目】某同学设计如图装置进行乙醇氧化反应的探究实验,有关说法不正确的是()
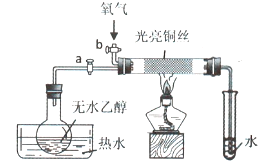
A.热水的作用是促使乙醇挥发,为硬质玻璃管内提供乙醇蒸汽
B.通入乙醇蒸汽反应的过程中,撤离酒精灯后反应仍能进行
C.在硬质玻璃管内发生的主反应为:![]()
D.实验结束时,先停止加热,再关闭活塞a、b,最后将导管移出水面
【答案】D
【解析】
由实验装置可知,热水加热无水乙醇,促进乙醇的挥发,打开a、b,在大试管中发生![]() ,为放热反应,撤离酒精灯后反应仍能进行,实验结束后先撤导管后撤酒精灯,防止倒吸,以此来解答。
,为放热反应,撤离酒精灯后反应仍能进行,实验结束后先撤导管后撤酒精灯,防止倒吸,以此来解答。
A.因乙醇易挥发,热水的作用是促使乙醇挥发,为硬质玻璃管内提供乙醇蒸汽,故A正确;
B.通入乙醇蒸汽反应的过程中,撤离酒精灯后反应仍能进行,与催化氧化反应为放热反应有关,故B正确;
C.乙醇可催化氧化生成乙醛,反应为![]() ,故C正确;
,故C正确;
D.实验结束时,关闭活塞a、b,先将导管移出水面,再停止加热,防止倒吸使大试管炸裂,故D错误;
故选:D。

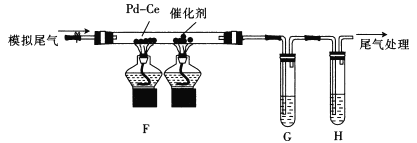
【题目】下列实验设计能够成功的是( )
选项 | 实验目的 | 实验步骤及现象 |
A | 检验亚硫酸钠试样是否变质 | 试样 |
B | 检验某盐是否为铵盐 | 试样 |
C | 证明酸性条件下H2O2氧化性比I2强 | NaI溶液 |
D | 除去硝酸钾晶体中少量氯化钠 | 试样 |
A.AB.BC.CD.D
【题目】
Ⅰ.室温下,现有c(H+) 相同的醋酸甲和盐酸乙:
(1)相同条件下,取等体积的甲乙两溶液,各稀释100倍。稀释后的溶液,其c(H+) 大小关系为:
甲 _____________乙 (填“大于”“小于”或“等于”,下同)。
(2)各取25 mL的甲乙两溶液,分别与等浓度的NaOH稀溶液完全反应,则消耗的NaOH溶液的体积大小关系为V(甲) _____________ V(乙)。
Ⅱ.已知25 ℃时有关弱酸的电离平衡常数如下:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
(1)25 ℃时,将20 mL 0.1 mol·L-1 CH3COOH溶液和20 mL 0.1 mol·L-1 HSCN溶液分别与20 mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:
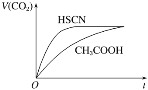
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 _____________。
(2)若保持温度不变,在醋酸溶液中通入一定量氨气,下列各量会变小的是 ______________(填字母)。
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数
III.(1)HClO4H2SO4HCl和HNO3都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数,下列说法不正确的是 _________。
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | Ka1:6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
A.温度会影响这四种酸在冰醋中的电离常数
B.在冰醋酸中HClO4是这四种酸中最强的酸
C.在冰醋酸中H2SO4的电离方程式为H2SO4===2H++SO42-
D.这四种酸在冰醋酸中都没有完全电离,但仍属于强电解质
(2)亚磷酸是二元中强酸,25 ℃时亚磷酸(H3PO3)的电离常数为K1=1×10-2K2=2.6×10-7。
①试从电离平衡移动的角度解释K1为什么比K2大_______________________ 。
②写出亚磷酸的电离方程式(2步)_________________;_______________ 。
③请设计一种方案,使之能通过直观的实验现象判断醋酸的酸性强于H2S,该方案所用的试剂是 __________,反应的化学方程式为 _____________________。