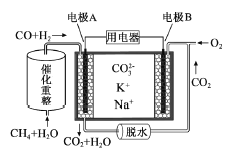
题目内容
【题目】依据叙述,写出下列反应的热化学方程式。
(1)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程式为_____________________________。
(2)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量。其热化学方程式为________________________________________________________________________。
(3)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量。其热化学方程式为_______________。
(4)已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为______________。
(5)某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知: N2(g)+2O2(g)==2NO2(g) ΔH1=+67.2kJ/mol N2H4(g)+O2(g)==N2(g)+2H2O(l) ΔH2=-534kJ/mol假如都在相同状态下,请写出发射火箭反应的热化学方程式。_______。
【答案】)CH3OH(l)+3/2O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1N2(g)+2O2(g)===2NO2(g)ΔH=+67.8 kJ·mol-1C2H2(g)+5/2O2(g)===2CO2(g)+H2O(l)ΔH=-1 300 kJ·mol-1N2(g)+3H2(g)=== 2NH3(g)ΔH=-92 kJ·mol-12N2H4(g)+ 2NO2(g)== 3N2(g)+4H2O(l) ΔH=-1135.2kJ·mol-1
【解析】
(1)1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,则64g即1mol甲醇燃烧放的热量为726kJ,热化学方程式为:CH3OH(l)+3/2O2(g) ![]() CO2(g)+2H2O(l) ;ΔH=-726 kJ·mol-1;
CO2(g)+2H2O(l) ;ΔH=-726 kJ·mol-1;
(2)若适量的N2和O2完全反应,每生成23 g NO2需要吸收16.95 kJ热量,所以每生成92gNO2(即2mol NO2)需要吸收67.8 kJ热量,则热化学方程式为:N2(g)+2O2(g)=2NO2(g)ΔH=+67.8 kJ·mol-1;
(3)在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量,所以有10NA个电子转移时,放出1 300 kJ的热量,则热化学方程式为:C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)ΔH=-1 300 kJ·mol-1;
(4)在反应N2(g)+3H2(g)2NH3(g)中,断裂3 mol H—H键和1 mol N≡N键共吸收热量3×436 kJ+946 kJ=2254 kJ,生成2molNH3,共形成6mol N—H键,放出的能量为:6×391 kJ=2346 kJ,吸收的能量少,放出的能量多,该反应为放热反应,放出的热量为:2346 kJ-2254 kJ=92kJ,所以热化学方程式为:N2(g)+3H2(g) 2NH3(g)ΔH=-92 kJ·mol-1;
(5)N2(g)+2O2(g)=2NO2(g) ΔH1=+67.2kJ/mol ①
N2H4(g)+O2(g)=N2(g)+2H2O(l) ΔH2=-534kJ/mol ②
由盖斯定律2②-①得到:2N2H4(g)+ 2NO2(g)= 3N2(g)+4H2O(l) ΔH=-1135.2kJ·mol-1。

【题目】类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是)
选项 | 已知 | 类推 |
A | 将Fe加入CuSO4溶液中:Fe+Cu2+=== Cu+Fe2+ | 将Na加入到CuSO4溶液中:2Na+Cu2+=== Cu+2Na+ |
B | 向Ca(ClO)2溶液中通入少量CO2:CO2+H2O+Ca2++2ClO-=== CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:SO2+H2O+Ca2++2ClO-=== CaSO3↓+2HClO |
C | 惰性电极电解氯化钠溶液:2Cl-+2H2O | 惰性电极电解MgBr2溶液:2Br-+2H2O |
D | 稀盐酸与NaOH溶液反应至中性:H++OH-===H2O | 稀硝酸与Ba(OH)2溶液反应至中性:H++OH-===H2O |
A. A B. B C. C D. D
【题目】甲、乙、丙三个容器中充入一定量的A和B,发生反应:A(g)+xB(g) ![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下表和下图表示:
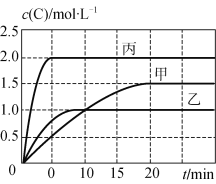
容器 | 甲 | 乙 | 丙 |
容积 | 0.5 L | 0.5 L | 1.0 L |
温度/℃ | T1 | T2 | T2 |
反应物 起始量 | 1.5 molA 0.5 molB | 1.5 molA 0.5 molB | 6.0 molA 2.0 molB |
下列说法正确的是
A. 10 min内甲容器中反应的平均速率v(A)=0.025 mol·L-1·min-1
B. 由图可知:T1<T2,且该反应为吸热反应
C. 若平衡时保持温度不变,改变容器体积平衡不移动
D. T1℃,起始时甲容器中充入0.5 molA、1.5 molB,平衡时A的转化率为25%