��Ŀ����
����Ŀ����ͨ�������£�����ͼ��ʾװ�����Ҷ�ȩ��OHC-CHO���Ʊ��Ҷ��ᣨH00C-COOH�������Ʊ���ӦΪ��OHC-CHO+2Cl2+2H2O��HOOC-COOH+4HCl������˵����ȷ����

A. ÿ����0.1mol�Ҷ�ȩ��Pt1���ų�2.24L���壨��״����
B. Pt1�ĵ缫��ӦΪ��4OH--4e-=2H2O+O2��
C. ÿ�õ�lmol�Ҷ��Ὣ��2molH+������Ǩ�Ƶ�����
D. ���������ṩCl-����ǿ�����Ե�����
���𰸡�D
��������A. ����ͼ��Pt1��Ϊ������������ԭ��Ӧ����Һ�е������ӷŵ�����������ÿ����0.1mol�Ҷ�ȩ��ת��0.4mol���ӣ�����0.2mol��������״���µ����Ϊ4.48L����A����B. ����A�ķ�����Pt1�ĵ缫�Ϸ��������ӵķŵ練Ӧ����B����C. ����A ������ÿ�õ�lmol�Ҷ��Ὣ��4molH+������Ǩ�Ƶ����ң���C����D. �������������ӵķŵ練Ӧ�����ɵ��������Ҷ�ȩ����Ϊ�Ҷ��ᣬ�������ṩCl-����ǿ�����Ե����ã���D��ȷ����ѡD��

����Ŀ�������仯�������������������й㷺��Ӧ�á�
�������ƣ�Na2FeO4����һ�����;�ˮ������ҵ���Ʊ��������Ƶķ�Ӧԭ��Ϊ��
Fe(OH)3 + NaClO + NaOH ��Na2FeO4 + X + H2O(δ��ƽ), ��X�ĵ���ʽΪ_______ ����Ӧ�б�������������_________��д��ѧʽ����
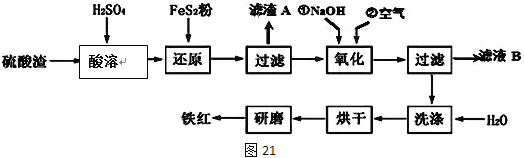
���������ϸ�ijЩ���ϻ�ϣ������Ƴɷ������ᡣ��ҵ���������������������Ҫ��Fe2O3��SiO2��Al2O3��MgO�ȣ����������Ʊ����죨Fe2O3���Ĺ������£�
��֪��
������ | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
��ʼ����pH | 2.7 | 3.8 | 7.6 | 9.4 |
��ȫ����pH | 3.2 | 5.2 | 9.7 | 12.4 |
��֪FeS2��һ�ֻ�ɫ������ˮ�Ĺ��塣
��1�����ܹ�����Fe2O3��ϡ���ᷴӦ�Ļ�ѧ����ʽΪ______________________��
������A����Ҫ�ɷݵĻ�ѧʽΪ__________________��
��2����ԭ�����м���FeS2��Ŀ���ǽ���Һ�е�Fe3+��ԭΪFe2+��������������ΪH2SO4��д���÷�Ӧ�����ӷ���ʽ_________________��
��3��Ϊȷ������������ʹ��ȣ����������м�NaOH������ҺpH�ķ�Χ��____�������NaOH������ҺpH=a������ҺB��c��Fe3+��=____mol/L��25��ʱ��Ksp[Fe(OH)3]=4��10��38��
��4���Լ��ѡ�����������������ҺΪԭ�ϣ�ʯīΪ�缫���Թ���ȼ�ϵ�ء��õ�ظ����ĵ缫��ӦʽΪ________________ ��