题目内容
在V mL Al2(SO4)3溶液中含有Al3+m g,取
mL该溶液用水稀释至4V mL,则SO42-物质的量浓度为( )
| V |
| 4 |
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:根据n=
计算mg Al3+的物质的量,进而计算
mL溶液中Al3+的物质的量,根据电荷守恒可知2n(SO42-)=3n(Al3+),据此计算
mL溶液中SO42-的物质的量,稀释为4VmL,溶液中SO42-的物质的量不变,再根据c=
计算稀释后溶液SO42-的物质的量浓度.
| m |
| M |
| V |
| 4 |
| V |
| 4 |
| n |
| V |
解答:
解:mg Al3+的物质的量为
=
mol,
故
mL溶液中Al3+的物质的量为
mol×
=
mol,
根据电荷守恒可知2n(SO42-)=3n(Al3+),故
mL溶液中SO42-的物质的量为
mol×
=
mol,
取
mL溶液稀释到4V mL,则稀释后溶液SO42-的物质的量浓度为
=
mol/L,
故选A.
| m g |
| 27g/mol |
| m |
| 27 |
故
| V |
| 4 |
| m |
| 27 |
| 1 |
| 4 |
| m |
| 108 |
根据电荷守恒可知2n(SO42-)=3n(Al3+),故
| V |
| 4 |
| m |
| 108 |
| 3 |
| 2 |
| m |
| 72 |
取
| V |
| 4 |
| ||
| 4V×10-3L |
| 125m |
| 36V |
故选A.
点评:本题考查物质的量浓度的有关计算,难度不大,属于字母型计算,容易计算出问题,注意对公式的理解与灵活运用.

练习册系列答案
相关题目
常温条件下,将SO2气体通入一定量的NaOH溶液中,所得溶液呈中性,关于该溶液判断正确的是( )
| A、该溶液中的溶质为NaHSO3 |
| B、溶液中的离子浓度最大的是Na+ |
| C、溶液中C(Na+)=C(SO32-)+C(HSO3-) |
| D、该溶液的溶质为NaHSO3和NaOH |
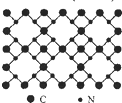 根据量子力学计算,氮化碳结构有五种,其中一种氮化碳硬度超过金刚石晶体,成为首届一指的超硬新材料,已知该氮化碳的二维晶体结构如图所示.下列有关氮化碳的说法正确的是( )
根据量子力学计算,氮化碳结构有五种,其中一种氮化碳硬度超过金刚石晶体,成为首届一指的超硬新材料,已知该氮化碳的二维晶体结构如图所示.下列有关氮化碳的说法正确的是( )| A、氮化碳属于分子晶体 |
| B、氮化碳的分了式为C3N4 |
| C、该晶体中的碳、氮原子核外都满足8电子稳定结构 |
| D、每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连 |
下列各组离子,在强酸性溶液中可以大量共存的是( )
| A、Na+、Ba2+、Cl-、SO32- |
| B、Na+、Ba2+、AlO2-、NO3- |
| C、NH4+、K+、Cl-、NO3- |
| D、Na+、K+、NO3-、SiO32- |
在元素周期表的金属元素和非金属元素交界处,最容易找到的材料是( )
| A、制半导体的材料 |
| B、耐高温、耐腐蚀的合金材料 |
| C、制农药的材料 |
| D、制催化剂的材料 |
某醇在适当条件下与足量的乙酸发生酯化,得到的酯的相对分子质量a与原来醇的相对分子量b的关系是a=b+84,有关该醇应该具有的结构特点的描述正确的是( )
| A、该醇分子中一定具有甲基 |
| B、该醇分子中一定没有甲基 |
| C、该醇分子中至少含有三个碳原子 |
| D、该醇分子中具有两个醇羟基 |
一定量的铜与100mL一定浓度的硝酸恰好完全反应生成硝酸铜和NO、NO2、N2O4的混合气体,将该混合气体收集在集气瓶中,把集气瓶倒立在水中,通入4.48L的氧气(在标准状况下)可以使集气瓶充满溶液.则下列说法一定正确的是( )
| A、铜的质量为12.8g |
| B、硝酸的物质的量浓度为12mol?L-1 |
| C、体现酸性的硝酸为0.8mol |
| D、被还原的硝酸为0.4mol |
在BaCl2溶液中通入足量SO2气体溶液仍澄清,此澄清溶液通入下列气体仍无明显现象的是( )
| A、NO2 |
| B、Cl2 |
| C、NH3 |
| D、CO2 |
下列说法正确的是( )
| A、氯化钠熔化或氯化氢溶于水时都要破坏化学键 |
| B、常温常压下,18g D2O含有6.02×1024个电子 |
| C、标准状况下,11.2L SO3所含3.01×1023个分子 |
| D、离子化合物中可能含有共价键,共价化合物中一定不含有离子键 |