题目内容
把6molA气体和5molB气体混合放入4L密闭容器中,在一定条件下发生反应:3A(g)+B(g) 2C(g)+xD(g),经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(L·min),计算
2C(g)+xD(g),经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(L·min),计算
(1)x (2) B的转化率
(3) 平衡时A的浓度 (4) 恒温达平衡时容器内的压强与开始时压强比
 2C(g)+xD(g),经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(L·min),计算
2C(g)+xD(g),经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(L·min),计算(1)x (2) B的转化率
(3) 平衡时A的浓度 (4) 恒温达平衡时容器内的压强与开始时压强比
(1)2 (2)20℅ (3) 0.75 mol/L (4) 1:1
试题分析:(1)D的物质的量为n(D)=0.1mol?(L?min)-1×5min×4L=2mol,物质的量之比等于化学计量数之比,所以2:x=2mol:2 mol,解得x=2,
答:x的值是2;
(2)参加反应的B的物质的量n(B)=1/2n(C)=(1/2)×2mol=1mol,所以B的转化率为α=1mol÷5mol×100%=20%,
答:B的转化率为20%;
(3)△n(A)=(3/2)×2mol=3mol,n(A)平衡=n(A)起始-△n(A)=6mol-3mol=3mol,所以c(A)平衡= n(A)平衡÷V=3mol÷4L=0.75mol/L,
答:平衡时A的物质的量浓度为0.75mol/L;
(4)3A(g)+B(g)
 2C(g)+2D(g),即反应前总的物质的量相等,根据压强之比等于物质的量之比,故恒温达平衡时容器内的压强与开始时压强比为1:1。
2C(g)+2D(g),即反应前总的物质的量相等,根据压强之比等于物质的量之比,故恒温达平衡时容器内的压强与开始时压强比为1:1。答:恒温达平衡时容器内的压强与开始时压强比为1:1。
点评:本题考查化学平衡的计算,题目难度不大,注意对基础知识的理解、积累。

练习册系列答案
相关题目
 2HI(g)(HI为无色气体)已达平衡状态的是( )
2HI(g)(HI为无色气体)已达平衡状态的是( )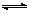 CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2 L的密闭容器中加入4 mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2 L的密闭容器中加入4 mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。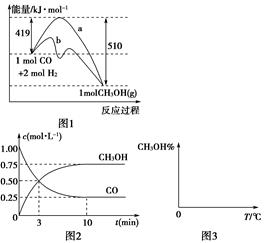
 O2(g)=CO2(g)+2H2O(g) ΔH=-192.9 kJ/mol
O2(g)=CO2(g)+2H2O(g) ΔH=-192.9 kJ/mol 3C(g)的下列叙述中,能说明反应已达到平衡的是
3C(g)的下列叙述中,能说明反应已达到平衡的是 2S(g)+R(s)下列说法可以说明反应已达平衡的是
2S(g)+R(s)下列说法可以说明反应已达平衡的是
 2Z(g),平衡常数K="40"
2Z(g),平衡常数K="40" 2C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则下列说法正确的是
2C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则下列说法正确的是  2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙三个容积均为2L的恒容密闭容器中投入SO2(g)和O2(g),其起始物质的量及SO2的平衡转化率如下表所示。 2Y(g) + Z(g),生成物Z 在反应混合物中的体积分数(ψ)与反应时间(t)的关系图正确的是( )
2Y(g) + Z(g),生成物Z 在反应混合物中的体积分数(ψ)与反应时间(t)的关系图正确的是( )