题目内容
(20分)在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
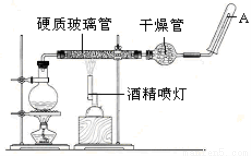
请回答该实验中的问题。
(1)写出该反应的反应方程式: ;并指明该氧化还原反应的还原剂是 ,氧化剂是 。
(2)实验前必须对整套装置进行气密性检查,操作方法是 。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是 ;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是 。
(4)干燥管中盛装是的物质是 ,作用是 。
(5)试管中收集气体是 ,如果要在A处玻璃管处点燃该气体,则必须对该气体进行 。
(1)3Fe+4H2O(g)  Fe3O4+H2 ;Fe;H2O
Fe3O4+H2 ;Fe;H2O
(2)将A端连接乳胶管和导管插入水中,用酒精灯微热圆底烧瓶,若有气泡产生,并停止加热后回升一段水柱,表示装置气密性良好
(3)提供水蒸气;防止发生暴沸 (4)碱石灰; 除去氢气中的水蒸气
(5)H2 ;验纯;收集一小试管氢气,管口向下,靠近火焰,松开手指,若听到噗的一声,表示纯净
【解析】
试题分析:(1)Fe与水蒸气反应生成四氧化三铁和氢气,该反应为3Fe+4H2O(g) Fe3O4+4H2↑;Fe元素的化合价升高,Fe为还原性,H元素的化合价降低,则水为氧化剂;
Fe3O4+4H2↑;Fe元素的化合价升高,Fe为还原性,H元素的化合价降低,则水为氧化剂;
(2)中学阶段检查装置气密性常用方法有两种:一种是利用热胀冷缩原理,另一种是利用气压原理。气压原理一般只有涉及到液体时才能用得到,这里显然是利用热胀冷缩原理。利用热胀冷缩原理时要注意步骤一定要完整,既要证明“热胀”,也要证明“冷缩”,即在玻璃管口A处接一段乳胶管,乳胶管头上连一段玻璃管,并将管口没入水中,用酒精灯火焰微热烧瓶底部,如果能够观察到没入水中的玻璃管口有气体逸出,停止加热后,玻璃管内有水柱上升,且较长时间水柱不回落,则标明该套装置气密性良好;
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是提供水蒸气;碎瓷片可防止暴沸发生,故答案为:防止暴沸;
(4)干燥管中的物质干燥氢气,则选碱石灰干燥剂来除去氢气中的水蒸气;
(5)该反应生成氢气,为可燃性气体,点燃前应验纯,否则气体不纯点燃会发生爆炸,操作为收集一小试管氢气,管口向下,靠近火焰,松开手指,若听到噗的一声,表示纯净。
考点:本题以铁与水的反应考查氧化还原反应、化学实验基本操作等

下列实验操作完全正确的是
编号 | 实验 | 操作 |
A | 钠与水反应 | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中 |
B | 配制一定浓度的氯化钾溶液1000mL | 准确称取氯化钾固体,放入到1000mL的容量瓶中,加水溶解,振荡摇匀,定容 |
C | 排除碱式滴定管尖嘴部分的气泡 | 将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出 |
D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接受容器,上层液体继续从分液漏斗下端管口放出 |
(17分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:N2(g)+3H2(g)  2NH3(g) △H= -92.4 kJ/mol,据此回答以下问题:
2NH3(g) △H= -92.4 kJ/mol,据此回答以下问题:
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是 (填序号)。
①反应压强为20Mpa~50Mpa
②500℃的高温
③铁触媒作催化剂
④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中。
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示(T-温度)。则T2 T1(填>、=、<),
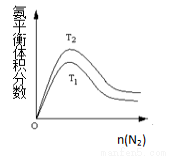
判断的依据是: 。(3分)
(3)合成氨气所需的氢气可以由水煤气分离得到。
涉及反应信息如下:
反应一:C(s)+H2O(g)  H2(g)+CO(g) 平衡常数K1
H2(g)+CO(g) 平衡常数K1
反应二:CO(g)+H2O(g)  H2(g)+CO2(g) 平衡常数K2
H2(g)+CO2(g) 平衡常数K2
① K1的表达式:K1= 。(3分)
②将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
实验组别 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
3 | T | a | b | c | d | t |
(Ⅰ)实验1中,用CO2表示反应开始到平衡的平均反应速率为 。
(Ⅱ)在实验3,当a=0.5、b=1时,要使c、d数据与实验2相同,且t<3,可以采取的措施为 (填序号)(3分)
A.其它条件不变温度T<900℃ B.其它条件不变温度T>900℃
C.充入一定量氖气 D.使用高效催化剂
(Ⅲ)对于反应二,当升高温度时K2 (填“增大”、“减小”或“不变”)。