题目内容
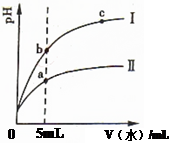
一定温度下,在2L恒容密闭容器中发生反应:2N2O5(g) 4NO2(g)+ O2(g) △H﹥0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是
4NO2(g)+ O2(g) △H﹥0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是

 4NO2(g)+ O2(g) △H﹥0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是
4NO2(g)+ O2(g) △H﹥0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示,下列说法正确的是
| A.10min时,反应达到平衡 |
| B.达到平衡时N2O5的转化率为60% |
| C.0~20min内平均反应速率v(N2O5)=0.05mol?L-1?min-1 |
| D.曲线a表示NO2的物质的量随反应时间的变化 |
CD
试题分析:读图可知,20min时反应达到平衡,10min时反应没有达到平衡,仍向正反应方向进行,故A错误;读图可知,曲线b是表示反应物的物质的量随反应时间变化的示意图,且△n(N2O5)=(5.0—3.0)mol=2.0mol,则平衡时N2O5的转化率=2.0/5.0×100%=40%,故B错误;由于v=△c/△t=△n /(V?△t) =2.0mol÷2L÷20min=0.05mol/(L?min),故C正确;曲线a是表示生成物的物质的量随反应时间变化的示意图,该反应有两种生成物,由于变化物质的量之比等于化学方程式中系数之比,即(5.0—3.0)mol/(4.0—0)mol=2/4,由于曲线b表示N2O5的物质的量随反应时间的变化,则曲线a表示NO2的物质的量随反应时间的变化,故D正确。

练习册系列答案
相关题目
 ,测得CH4的平衡转化率与温度及压强的关系如图,下列有关说法一定正确的是
,测得CH4的平衡转化率与温度及压强的关系如图,下列有关说法一定正确的是
 HCOOH + CH3OH – Q(Q>0)
HCOOH + CH3OH – Q(Q>0)
 CH3OH(g)+H2O(g) ΔH <0 。500 ℃时,在体积为1 L的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是
CH3OH(g)+H2O(g) ΔH <0 。500 ℃时,在体积为1 L的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是
 Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表
Pb(s) + CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表
 CO2(g)+H2(g),CO的转化率和温度t的关系如下表:
CO2(g)+H2(g),CO的转化率和温度t的关系如下表: CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入