题目内容
碱金属单质的熔点顺序为Li>Na>K>Rb>Cs,试用金属晶体结构的知识加以解释.
【答案】
金属晶体的熔点高低取决于晶体中金属离子与自由电子之间的作用力大小,由库仑定律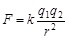 可知,作用力的大小又取决于金属离子的半径和自由电子的数量,显然,半径越小,作用力越强,熔点越高.而离子的半径顺序为
可知,作用力的大小又取决于金属离子的半径和自由电子的数量,显然,半径越小,作用力越强,熔点越高.而离子的半径顺序为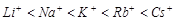 ,因此锂的熔点最高.
,因此锂的熔点最高.
【解析】试题分析:本题考查金属晶体熔沸点的比较方法。即金属键强弱的比较方法。金属键的实质是金属阳离子和自由电子的电性作用,故可以结合库伦定律加以分析,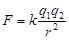 ,K为定值F大小取决于r和电量,r越小,电量越大,F越大,金属键越强烈,相应金属熔沸点越高。离子半径Li+<Na+<K+<Rb+<Cs+,故金属键自上而下逐渐减弱,熔沸点自上而下逐渐降低。
,K为定值F大小取决于r和电量,r越小,电量越大,F越大,金属键越强烈,相应金属熔沸点越高。离子半径Li+<Na+<K+<Rb+<Cs+,故金属键自上而下逐渐减弱,熔沸点自上而下逐渐降低。
考点:金属键强弱的比较
点评: 本题结合元素周律对金属强弱进行考查,相对形式较新颖,可以较好的考查学生能力。

练习册系列答案
相关题目