题目内容
【题目】室温时,1mol/L的HA和1mol/L的HB两种酸溶液,起始时的体积均为Vo,分别向两溶液中加水进行稀释,所得曲线如图所示。下列说法错误的是

A. M点溶液中c(A-)等于N点溶液中c(B-)
B. HA的电离常数约为10-4
C. 浓度均为0.1mol/L的NaA和HA混合溶液的pH<7
D. M、P两点的溶液分别用等浓度的NaOH溶液中和,消耗的NaOH溶液体积:P>M
【答案】D
【解析】试题分析:由图中信息可知,1mol/L的HA和1mol/L的HB两种酸溶液的pH分别为2和0,所以HA是弱酸、HB是强酸,HB已完全电离。因为两溶液浓度和体积均相等,故两溶液中所含一元酸的物质的量相等。A. M点溶液和N点溶液的pH都等于3,由电荷守恒可知,M点溶液中c(A-)等于N点溶液中c(B-),A正确;B. 1mol/L的HA溶液的pH为2,c(A-)=c(H+)=0.01mol/L,c(HA) ![]() 1mol/L,则HA的电离常数约为10-4,B正确;C. 浓度均为0.1mol/L的NaA和HA混合溶液中,c(HA)
1mol/L,则HA的电离常数约为10-4,B正确;C. 浓度均为0.1mol/L的NaA和HA混合溶液中,c(HA) ![]() c(A-),根据电离常数的表达式可知,c(H+)=Ka(HA)= 10-4mol/L,所以该溶液的pH<7,C正确;D. M、P两点的溶液所含一元酸的物质的量相等,故分别用等浓度的NaOH溶液中和时,消耗的NaOH溶液体积相等,D不正确。本题选D。
c(A-),根据电离常数的表达式可知,c(H+)=Ka(HA)= 10-4mol/L,所以该溶液的pH<7,C正确;D. M、P两点的溶液所含一元酸的物质的量相等,故分别用等浓度的NaOH溶液中和时,消耗的NaOH溶液体积相等,D不正确。本题选D。

 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案【题目】汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体.
(1)4CO(g)+2NO2(g)═4CO2(g)+N2(g)△H=﹣1 200kJmol﹣1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是(填代号).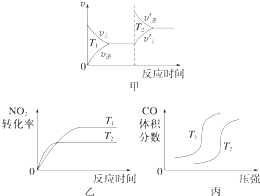
(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应:
CO(g)+H2O(g)CO2(g)+H2(g)△H<0.
820℃时在甲、乙、丙三个恒容密闭容器中,起始时按照下表进行投料,达到平衡状态,K=1.0.
起始物质的量 | 甲 | 乙 | 丙 |
n(H2O)/mol | 0.10 | 0.20 | 0.20 |
n(CO)/mol | 0.10 | 0.10 | 0.20 |
①该反应的平衡常数表达式为 .
②平衡时,甲容器中CO的转化率是 . 比较下列容器中CO的转化率:乙甲;丙甲(填“>”、“=”或“<”).
③丙容器中,通过改变温度,使CO的平衡转化率增大,则温度(填“升高”或“降低”),平衡常数K(填“增大”、“减小”或“不变”).
【题目】乙醚(CH3CH2OCH2CH3)曾经用作麻醉剂,实验室中可将乙醇、浓硫酸的混合液加热至 140℃制取一定量的乙醚,制备原理、装置、有关物质的部分性质如下(夹持装置、加热仪器和沸石均略去):
2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O

沸点/℃ | 水溶性 | 密度(g/mL) | |
乙醇 | 78 | 混溶 | 0.8 |
乙醚 | 34.6 | 难溶 | 0.7 |
回答下列问题:
(1)温度计 X 的水银球应位于_____________________。
(2)使用仪器 B 与不使用仪器 B 相比,其优点是_____________________。
(3)所得到的乙醚中含有一定量的乙醇及酸性物质。为得到高纯度的乙醚,可依次用NaOH 溶液、水洗涤;然后用无水 CaCl2干燥,最后进行蒸馏精制。
① 洗涤操作应在_____________(填仪器名称)中进行。
② 蒸馏精制时,最好的加热方式是________________________。
③ 若实验中使用了57.5mL 无水乙醇, 最后得到乙醚 18.0mL,则乙醚的产率为_____。
(4)实验中,发现 A 中的液体会变黑; E 中的溶液会逐渐褪色,加热后又会变红。
① A 中溶液颜色变黑的原因是________________________
②乙醇、浓硫酸的混合液在加热条件下会有副反应发生,生成两种常见的无机气体,该副反应的化学方程式为______________________。
(5)要证明该反应中有 CO2生成,在 F 后面连接一个盛有澄清石灰水的洗气瓶,并将F中的液体改为______溶液。
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号 | HA物质的量浓度 | NaOH物质的量浓度 | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸 .
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2(选填“是”或“否”).混合液中离子浓度c(A﹣)与 c(Na+)的大小关系是 .
(3)丙组实验结果分析,HA是酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是 .
(4)丁组实验所得混合溶液中由水电离出的c(OH﹣)=molL﹣1 . 写出该混合溶液中下列算式的精确结果(不需做近似计算).c(Na+)﹣c(A﹣)=molL﹣1 c(OH﹣)﹣c(HA)=molL﹣1 .




