题目内容
【题目】铜元素位于元素周期表中第ⅠB族,在化合物中其化合价可以呈现+1、+2 价。铜的单质及其化合物在很多领域有重要的应用。
Ⅰ.CuSO4和Cu(NO3)2是常见的+2价铜的化合物,有较为广泛的应用。
(1)向CuSO4溶液中滴加氨水,最后可以得到深蓝色的[Cu(NH3)4]SO4溶液。
①N、O、S三种元素的第一电离能由大到小的顺序为______________________________。
②比较NH3 和[Cu(NH3)4]2+中H-N-H键角的大小:NH3___________[Cu(NH3)4]2+(填“>”或“<”),并说明理由________________________。
(2)制备Cu(NO3)2的一种方法是在N2O4的乙酸乙酯溶液中加入铜,反应一段时间后,加热即可得到Cu(NO3)2。
①NO3- 的立体构型的名称为_______________,N原子的杂化方式为________________。NO3- 的一种等电子体为________________________。
②N2O4会发生类似于水的自偶电离N2O4![]() NO++NO3- ,制备无水Cu(NO3)2的化学方程式为__________________________________________。
NO++NO3- ,制备无水Cu(NO3)2的化学方程式为__________________________________________。
Ⅱ.CuCl是较为常见的+1价铜的化合物。
(3)基态Cu+ 的价层电子排布式为________________________。
(4)CuCl的晶胞结构如图所示,C1原子位于立方体的顶点和面心,Cu原子位于Cl原子构成的四面体体心。
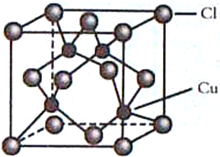
①每个Cl原子周围距Cl原子最近且等距离的Cu原子数目为________________。
②设NA为阿伏加德罗常数的值,晶体的密度为ρg/cm3,CuCl的摩尔质量为M g/mol,计算晶胞中距离最近的两个Cu原子间的距离为___________pm。
【答案】 N>O>S < 因为NH3 提供孤对电子与Cu2+ 形成配位键后,N-H成键电子对受到的排斥力减小,所以H-N-H键角增大 平面三角形 sp2杂化 CO32-、SO3 Cu+2N2O4![]() Cu(NO3)2+2NO↑ 3d10 4
Cu(NO3)2+2NO↑ 3d10 4 ![]()
【解析】(1)①非金属性越强,第一电离能越大,由于氮元素的2p轨道电子处于半充满状态,稳定性强,则N、O、S三种元素的第一电离能由大到小的顺序为N>O>S。②由于NH3提供孤对电子与Cu2+ 形成配位键后,N-H成键电子对受到的排斥力减小,所以H-N-H键角增大。(2)①NO3-中中心原子的价层电子对数是![]() ,因此硝酸根的立体构型的名称为平面三角形,N原子的杂化方式为sp2杂化。原子数和价电子数分别都相等的互为等电子体,则NO3-的一种等电子体为CO32-或SO3。②N2O4会发生类似于水的自偶电离N2O4
,因此硝酸根的立体构型的名称为平面三角形,N原子的杂化方式为sp2杂化。原子数和价电子数分别都相等的互为等电子体,则NO3-的一种等电子体为CO32-或SO3。②N2O4会发生类似于水的自偶电离N2O4![]() NO++NO3-,因此制备无水Cu(NO3)2的同时还有NO生成,反应的化学方程式为Cu+2N2O4
NO++NO3-,因此制备无水Cu(NO3)2的同时还有NO生成,反应的化学方程式为Cu+2N2O4![]() Cu(NO3)2+2NO↑。(3)铜的原子序数是29,基态Cu+的价层电子排布式为3d10。(4)①根据晶胞结构结合化学式可判断每个Cl原子周围距Cl原子最近且等距离的Cu原子数目为4个。②晶胞的边长是
Cu(NO3)2+2NO↑。(3)铜的原子序数是29,基态Cu+的价层电子排布式为3d10。(4)①根据晶胞结构结合化学式可判断每个Cl原子周围距Cl原子最近且等距离的Cu原子数目为4个。②晶胞的边长是![]() ,晶胞中距离最近的两个Cu原子间的距离为面对角线的一般,即为
,晶胞中距离最近的两个Cu原子间的距离为面对角线的一般,即为![]() 。
。

 名校课堂系列答案
名校课堂系列答案