��Ŀ����
����Ŀ������һ��������Na2O���ʵ�Na2O2��Ʒ�������ʵ��ⶨ����Ʒ�Ĵ��ȡ��ɹ�ѡ���װ����ͼ��
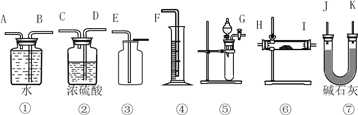
��1��ѡ������װ�ÿ�����װһ����IJⶨ����������Ʒ���ȵ�ʵ��װ�ã�ѡ������������____________��
A���٢ڢܢ� B���٢ܢ�
C���ݢޢ� D���٢ۢݢ�
��2��ʵ����ѡ��װ�õ�����˳����_________________������ӿڵ���ĸ�����ӽ���ʡ�ԣ���
��3��д��ʵ����Na2O2������Ӧ�Ļ�ѧ����ʽ,����˫���ű�ע����ת�Ƶķ������Ŀ__________������ʼʱ�����Ʒ������Ϊ2.0 g����Ӧ���������������Ϊ168mL(��״��)����Na2O2�����Ĵ���Ϊ_________��
��4������ɫʯ����Һ�м���Na2O2��ĩ��������ȷ��������________��
A�������Һ���� B����Һ�ȱ�������ɫ
C����Һ��Ϊ��ɫ �� D����ΪNa2O2��ʯ���������ԭ��Ӧ�������ݲ���
���𰸡� B GABF  58.5% B
58.5% B
����������1��Na2O2����ˮ��CO2��Ӧ����O2��Na2O��ˮ��CO2��Ӧ�������O2�����Կ������������������������Ƶ���������һ��������������ƵĴ��ȡ�ѡ������װ����װһ����IJⶨ����������Ʒ���ȵ�ʵ��װ�ã�����ö�����̼Ϊԭ�ϣ�װ�ø��ӣ���ʵ�����������ˮΪԭ�ϣ�װ�ü�ֻ��Ҫ�٢ܢݼ��ɣ���ѡB��
��2����ˮΪԭ�����ʵ�飬��Ϊ��Ʒ��ˮ��Ӧװ�ã���Ϊ��ˮ���ռ�����װ�ã���Ϊͨ�������ų���ˮ���������������װ�ã�����ʵ����ѡ��װ�õ�����˳����GABF��
��3��Na2O2��ˮ��Ӧ�����������ƺ�������Na2O2��OԪ����-1�۱�Ϊ0�ۺ�-2�ۣ����ݻ��ϼ������������(��ʧ�����غ�)��д����ѧ����ʽ������˫���ű�ע����ת�Ƶķ������ĿΪ�� ������֪���������������ʵ���Ϊ��0.168L��22.4L/mol=0.0075mol���ָ��ݻ�ѧ����ʽ�ɵã�2molNa2O2��ˮ��Ӧ����1mol��������Na2O2Ϊ0.015mol������Ϊ��0.015mol��78g/mol=1.17g������Na2O2�����Ĵ���Ϊ��1.17g��2.0g��100%=58.5%��
������֪���������������ʵ���Ϊ��0.168L��22.4L/mol=0.0075mol���ָ��ݻ�ѧ����ʽ�ɵã�2molNa2O2��ˮ��Ӧ����1mol��������Na2O2Ϊ0.015mol������Ϊ��0.015mol��78g/mol=1.17g������Na2O2�����Ĵ���Ϊ��1.17g��2.0g��100%=58.5%��
��4������������ˮ��Ӧ�����������ƺ���������Һ�������ݲ���������������Һ�Լ��ԣ��������ƹ���������ǿ�����ԣ���ʹ��ɫʯ����Һ����������ɫ��������Һ�ȱ�������ɫ����ѡB��

 ��ɢ˼ά�¿���ϵ�д�
��ɢ˼ά�¿���ϵ�д�����Ŀ��������Ԫ��A��B��C��D�����ڱ��е�λ����ͼ��ʾ��B��D����������֮��Ϊ12�����߿��γ�DB2��DB3���ַ��ӣ�DB2����Ư���ԣ�
A | B | |
C | D |
�ش��������⣺
��1��Aλ��Ԫ�����ڱ����ڣ��壬���⻯��ķ���ʽ�� ��
��2�����������У���ȷ����������ĸ����
a���ȶ��ԣ�A���⻯�C���⻯�� b����ԭ�ԣ�B2����D2��
c�����ԣ�H4CO4��H2DO4 d������ϼ�ֵ��D=B��A��C
��3��DB2ͨ�����й������̿��ƻ���ҵԭ��H2DB4�������ԴH2 �� 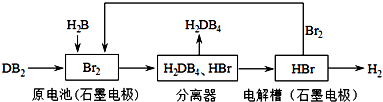
��ԭ�����DB2���뷴Ӧ�ĵ缫Ϊ �� д���缫��Ӧʽ������5mol DB2�μӷ�Ӧ��������Ӧ������ģ��������ɱ�״����L H2 ��
��Ϊ����������ķ���Ч����ȡ������H2DB4��Һ���Թܣ���������μ���AgNO3��Һ����ַ�Ӧ�����۲쵽 �� ֤������Ч���Ϻã�
�۽��ù����������ܷ�Ӧ�Ļ�ѧ����ʽ��ʾΪ��