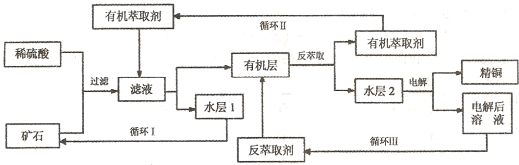
题目内容
有铁粉、铜粉和Cu(OH)2三种固体,以及CuSO4、KOH、FeSO4、KNO3、K2SO4和稀硫酸等六种溶液,它们中的某几种在常温下相互转化,关系如下:(1)固体甲+溶液B![]() 溶液C+水
溶液C+水
(2)溶液A+溶液C![]() 固体甲+溶液D
固体甲+溶液D
(3)固体乙+溶液B![]() 溶液E+氢气
溶液E+氢气
根据以上关系,写出下列物质的化学式。
固体:甲_______________,乙________________,
溶液:A______________,B________________,C________________,?D________________,E________________,F________________。
写出所有发生反应的离子方程式:
(1)_______________________________________________________________。
(2)_______________________________________________________________。
(3)_______________________________________________________________。
解析:分析上述物质及所给条件关系,找出解题的突破口;固体乙与溶液B反应产生氢气,则乙只能为铁,B为稀硫酸,E为FeSO4;固体甲与稀硫酸反应,则甲为Cu(OH)2,C为?CuSO4。A与CuSO4溶液反应生成Cu(OH)2,则A为KOH,D为K2SO4。
答案:Cu(OH)2 Fe KOH H2SO4 CuSO4 K2SO4 FeSO4 KNO3
(1)Cu(OH)2+2 H+====Cu2++2H2O
(2)Cu2++2 OH-====Cu(OH)2↓
(3)Fe+2 H+====Fe2++H2↑

制印刷电路时常用FeCl3溶液作为“腐蚀液”,发生的反应为:
2 FeCl3 + Cu = 2FeCl2 + CuCl2
向盛有FeCl3溶液的烧杯中加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
| A.有 Cu无Fe | B.有Fe无Cu |
| C.Fe、Cu都有 | D.Fe、Cu都无 |
A、B、C、D、E、F六种强电解质,它们在水中电离出的离子如右表所示,
阳离子 | Cu2+、K+、Fe2+、H+ |
阴离子 | SO42— 、OH- 、NO3- |
其中A、D、F电离产生的阳离子均为K+。另有甲、乙、丙三种固体,它们分别是铁粉、铜粉和Cu(OH)2固体中的某一种,它们与A、B、C、D、E在常温下有如下转化关系:
①固体乙+B溶液→E溶液+氢气
②固体甲+B溶液→C溶液+水
③A溶液+C溶液→固体甲+D溶液
请回答下列问题:
(1)写出下列物质的化学式:甲 ,乙 ,F 。
(2)写出下列反应的离子方程式:
反应① ;
反应③ 。
(3)用题目所涉及到的物质表示丙→C的化学方程式____________________
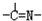 三种基团,无环状结构,三种基团的数目关系为n3=
三种基团,无环状结构,三种基团的数目关系为n3=