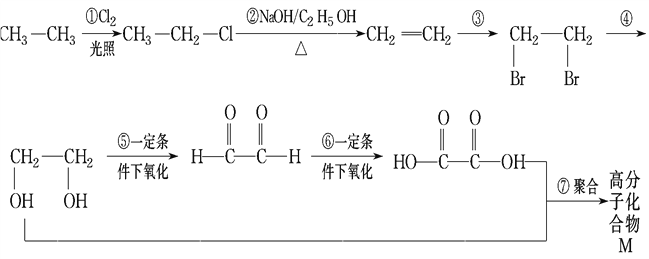
题目内容
【题目】某2.0L硫酸溶液中含有1.0mol H2SO4 . 向上述溶液中加入足量铁粉,试回答下列问题:
(1)写出该反应的离子方程式;
(2)溶液中H2SO4的物质的量浓度;
(3)产生气体的体积(标准状况);
(4)假设反应前后溶液体积不变,则所得溶液中Fe2+的物质的量浓度为 .
【答案】
(1)Fe+2H+═Fe2++H2↑
(2)0.5mol/L
(3)22.4L
(4)0.5mol/L
【解析】解:(1)铁与硫酸反应生成硫酸亚铁和氢气,离子方程式为:Fe+2H+═Fe2++H2↑,所以答案是:Fe+2H+═Fe2++H2↑;(2)c(H2SO4)= ![]() =0.5mol/L,所以答案是:0.5mol/L;(3)根据反应的方程式列式计算:
=0.5mol/L,所以答案是:0.5mol/L;(3)根据反应的方程式列式计算:
Fe+ | H2SO4 | = | FeSO4+ | H2↑ |
1mol | 22.4 L | |||
1.0 mol | V(H2) |
V(H2)= ![]() =22.4L,
=22.4L,
所以答案是:22.4L;(4)n(Fe2+)=n(SO42﹣)=1.0 mol
c(Fe2+)= ![]() L=0.5 mol/L
L=0.5 mol/L
所以答案是:0.5 mol/L.

【题目】以软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)为原料(已知两种原料中均不含有单质杂质)制备高纯度硫酸锰的工艺流程如图所示。
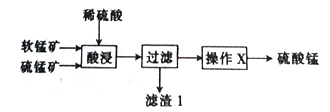
(1)已知滤渣1中含有一种非金属单质,该非金属单质的化学式为_____________________。
(2)已知二氧化锰与硫化锰的物质的量之比对酸浸时的浸出率有影响,相关实验数据如下表所示。当二氧化锰与硫化锰的物质的量之比为______________时,为最优反应配比。
号 | 二氧化锰与硫化锰的物质的量之比 | 浸出液的pH | 浸出率% |
1 | 1.25:1 | 2.5 | 95.30 |
2 | 1.75:1 | 2.5 | 97.11 |
3 | 2.25:1 | 2.5 | 99.00 |
4 | 2.5:1 | 2.5 | 98.40 |
(3)操作X为蒸发浓缩、______________、过滤,洗涤、烘干,在洗涤操作中,常用酒精洗涤MnSO4·H2O晶体,其主要目的是_________。
(4)现有10t锰矿,其中MnO2和MnS的含量均为29%,若流程中Mn的损耗率为10%,则最终制得硫酸锰(MnSO4·H2O)_________t。