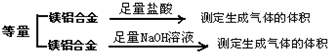
题目内容
某主族元素R原子的质量数为79,已知R离子含有45个中子和36个电子,下列关于R元素的叙述错误的是( )
| A、R元素属于ⅡA族 |
| B、R元素在周期表里处于第4周期 |
| C、R元素最高氧化物对应水化物的分子式为H2R04 |
| D、R元素气态氢化物的分子式为H2R |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:某主族元素R原子的质量数为79,R离子含有45个中子和36个电子,R原子核外电子数=原子序数=79-45=34,则R为Se元素,R离子核外电子数是36,则R形成的离子为R2-,R最外层有6个电子,
A.根据其最外层电子数确定所属主族;
B.根据元素原子核外电子层数确定所属周期数;
C.R最外层有6个电子,其最高化合价为+6价;
D.R元素的最低负价为-2价,据此确定其氢化物化学式.
A.根据其最外层电子数确定所属主族;
B.根据元素原子核外电子层数确定所属周期数;
C.R最外层有6个电子,其最高化合价为+6价;
D.R元素的最低负价为-2价,据此确定其氢化物化学式.
解答:
解:某主族元素R原子的质量数为79,R离子含有45个中子和36个电子,R原子核外电子数=原子序数=79-45=34,则为Se元素,R离子核外电子数是36,则R形成的离子为R2-,R最外层有6个电子,
A.主族元素最外层电子数=族序数,所以R属于第VIA族元素,故A错误;
B.该元素原子核外有4个电子层,所以在周期表中位于第四周期,故B正确;
C.主族元素其最高正化合价与其族序数相等、最外层电子数相等,所以R元素最高正化合价为+6价,则R元素最高氧化物对应水化物的分子式为H2RO4,故C正确;
D.R元素的最低负价为-2价,所以R的氢化物的化学式为:H2R,故D正确;
故选A.
A.主族元素最外层电子数=族序数,所以R属于第VIA族元素,故A错误;
B.该元素原子核外有4个电子层,所以在周期表中位于第四周期,故B正确;
C.主族元素其最高正化合价与其族序数相等、最外层电子数相等,所以R元素最高正化合价为+6价,则R元素最高氧化物对应水化物的分子式为H2RO4,故C正确;
D.R元素的最低负价为-2价,所以R的氢化物的化学式为:H2R,故D正确;
故选A.
点评:本题考查了位置结构与性质的关系,题目难度中等,根据质量数和质子数、中子数的关系确定元素是解本题关键,再结合元素周期律、原子结构、元素化合价等知识点分析解答.

练习册系列答案
 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
下列反应属于吸热反应的是( )
| A、碳燃烧生成一氧化碳 |
| B、葡萄糖在人体内氧化分解 |
| C、锌粒与稀H2SO4反应制取H2 |
| D、Ba(OH)2?8H2O与NH4Cl(固体)反应 |
下列化学式与指定物质的主要成分对应正确的是( )
| A、Fe2O3--磁性氧化铁 |
| B、CaO--生石灰 |
| C、NaHCO3--纯碱 |
| D、CuSO4--胆矾 |
下列有关问题,与盐类的水解无关的是( )
| A、NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂 |
| B、盐酸可作铁制品的除锈剂 |
| C、实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞 |
| D、加热蒸干AlCl3溶液得到Al(OH)3固体 |
短周期金属元素甲~戊在周期表中的相对位置如下表所示,下面判断不正确的是( )
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A、原子半径:丙<丁<戊 |
| B、金属性:甲<丙 |
| C、氢氧化物碱性:丙>丁>戊 |
| D、最外层电子数:甲>乙 |
下列溶液中,由水电离出的c(H+)<10-7mol?L-1的是( )
| A、25℃时,0.01mol?L-1NH4Cl溶液 |
| B、25℃时,0.01mol?L-1NaHSO4溶液 |
| C、100℃时,0.01mol?L-1NaNO3溶液 |
| D、25℃时,0.01mol?L-1NaF溶液 |

 -CH3+Cl2→
-CH3+Cl2→ -CH2Cl+HCl
-CH2Cl+HCl

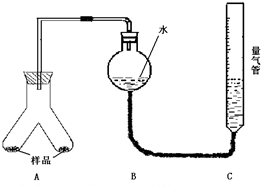 为测定镁铝合金(不含其它元素)中铝的质量分数,甲乙两个学习小组设计了下列二种不同的实验方案进行探究.请回答下列问题:
为测定镁铝合金(不含其它元素)中铝的质量分数,甲乙两个学习小组设计了下列二种不同的实验方案进行探究.请回答下列问题: