题目内容
【题目】铵明矾[NH4Al(SO4)2·12H2O]是分析化学常用的基准试剂,工业上常用铝土矿(主要成分为Al2O3)来生产铵明矾,其中Z的水溶液可用于伤口消毒,其工艺流程图如下:
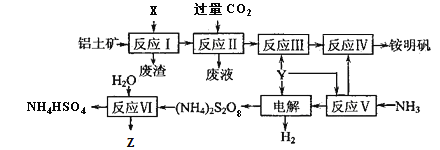
(1)写出反应Ⅱ的离子方程式____________________。
(2)25℃时,将0.2 mol·L-1的氨水与0.1 mol·L-1的Y溶液等体积混合,所得溶液的pH=5,则该温度下氨水的电离常数Kb≈_____________(忽略混合时溶液体积的变化)。
(3)从反应Ⅳ的铵明矾溶液中获得铵明矾晶体的实验操作依次为_____________、____________、过滤、洗涤(填操作名称)。
(4)“电解”时,用惰性材料作电极,则阳极电极反应式为__________________________。
(5)反应Ⅵ的化学方程式为______________________。
(6)废水中含有Fe2+、Mn2+等金属离子对自然环境有严重的破坏作用,,可用(NH4)2S2O8氧化除去。写出Mn2+被氧化生成MnO2的离子方程式为__________________________________。Z也有较强氧化性,在实际生产中不用Z氧化Mn2+的原因是_______________________________________。
【答案】 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 1×10-5 蒸发浓缩 冷却结晶 2SO42-—2e-= S2O82- (NH4)2S2O8+2H2O = 2NH4HSO4+H2O2 S2O82- + 2H2O + Mn 2+=4H+ + 2SO42- + MnO2↓ 锰的化合物可催化H2O2的分解,使消耗的H2O2增多
【解析】(1)氧化铝与强碱溶液反应生成偏铝酸盐溶液,向溶液中通入足量二氧化碳气体生成氢氧化铝和碳酸氢盐,离子方程式AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;正确答案:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-。
(2)根据题意可知,设溶液的体积均为1L,氨水和硫酸恰好完全反应生成硫酸铵0.1mol,根据水解反应NH4++H2O![]() NH3H2O+H+可知:所得溶液的pH=5,c(H+)=10-5mol/L, c(NH3H2O)= 10-5mol/L, 两溶液等体积混合,所以c(NH4+)=0.1 mol/L,根据水解平衡常数计算公式可得:Kh=KW/Kb= c(NH3H2O) ×c(H+)/ c(NH4+), KW=10-14,所以带入数值后得Kb≈1×10-5;正确答案:1×10-5。
NH3H2O+H+可知:所得溶液的pH=5,c(H+)=10-5mol/L, c(NH3H2O)= 10-5mol/L, 两溶液等体积混合,所以c(NH4+)=0.1 mol/L,根据水解平衡常数计算公式可得:Kh=KW/Kb= c(NH3H2O) ×c(H+)/ c(NH4+), KW=10-14,所以带入数值后得Kb≈1×10-5;正确答案:1×10-5。
(3)先把铵明矾水溶液进行蒸发浓缩 ,再降温结晶,过滤、洗涤,得到该物质的晶体,实验操作依次为蒸发浓缩 、冷却结晶; 正确答案:蒸发浓缩 、冷却结晶。
(4)有反应III可知,氢氧化铝溶于硫酸溶液生成硫酸铝,所以试剂Y为硫酸溶液,通过流程看出,溶液中的氢离子得电子变为氢气,那么只有硫酸根离子失电子变为S2O82-,则阳极电极反应式为2SO42-—2e-= S2O82-;正确答案:2SO42-—2e-= S2O82-。
(5)根据流程图看出,(NH4)2S2O8与水反应生成NH4HSO4,再根据原子守恒规律,得另外一种物质为H2O2,反应Ⅵ的化学方程式为(NH4)2S2O8+2H2O = 2NH4HSO4+H2O2 ;正确答案:(NH4)2S2O8+2H2O = 2NH4HSO4+H 2O2。
(6)根据氧化还原反应规律:Mn2+被氧化生成MnO2,S2O82-被还原为SO42-,根据电子守恒、电荷守恒、原子守恒写出离子方程式为S2O82- + 2H2O + Mn 2+=4H+ + 2SO42- + MnO2↓;正确答案:S2O82- + 2H2O + Mn 2+=4H+ + 2SO42- + MnO2↓。过氧化氢也有较强氧化性,但在实际生产中不用Z氧化Mn2+,原因是锰的化合物可催化H2O2的分解,使消耗的H2O2增多;正确答案:锰的化合物可催化H2O2的分解,使消耗的H2O2增多。

 名校课堂系列答案
名校课堂系列答案