题目内容
【题目】含钴化合物在机械制造、磁性材料等领域具有广泛的应用,请回答下列问题:
(1)基态Co3+的价电子排布图为____。
(2)钴的配合物[Co(NH3)5Br](NO3)2
①第一电离能N_____O(填“大于”、“小于”或“不能确定”);两种配位原子的杂化轨道类型均为____;
②钴离子周围配位键数目(配位数)是 ___;N03-的空间构型为____;
③已知Br的含氧酸酸性由强到弱的顺序为HBrO4>HBrO3>HBrO2>HBrO,其原因是____。
(3)某钴氧化物品体具有CoO2的层状结构如下图所示(小球表示Co,大球表示O)。下列用粗线面出的结构单元不能描述CoO2)的化学组成的是_____

(4)Co的另一种氧化物的晶胞如图,已知钴原子的半径为apm,氧原子的半径为b pm,它们在晶体中是紧密接触的,钴原子填在氧原子的 ___填“正八面体”、“正四面体”或“立方体”)空隙;钴原子与跟它次近邻的氧原子之间的距离为____;在该钴的氧化物品体中原子的空间利用率为____(均用含a、b的计算表达式表示)。

【答案】 ![]() 大于 sp3 6 平面(正)三角形 含氧酸的中心元素 相同时,非羟基氧越多,中心元素的正电性越高,导致Br-O-H中的O的电子向Br偏移,在水分子作用下也就越易电离H+ D 正八面体
大于 sp3 6 平面(正)三角形 含氧酸的中心元素 相同时,非羟基氧越多,中心元素的正电性越高,导致Br-O-H中的O的电子向Br偏移,在水分子作用下也就越易电离H+ D 正八面体 ![]()

【解析】(1)钴价电子为9,基态Co3+的价电子排布图为![]() ;(2)①氮的3P处于半充满状态,第一电离能N大于O;两种配位原子的杂化轨道类型均为sp3 ;②钴离子周围上下左右前后位置有氧原子,配位键数目(配位数)是6;氮形成3个δ键,sp2杂化,N03-的空间构型为平面(正)三角形 ;③已知Br的含氧酸酸性由强到弱的顺序为HBrO4>HBrO3>HBrO2>HBrO,其原因是含氧酸的中心元素 相同时,非羟基氧越多,中心元素的正电性越高,导致Br-O-H中的O的电子向Br偏移,在水分子作用下也就越易电离H+;(3)CoO2的重复结构单元示意图中Co、O原子数目之比应为1:2,由图象可知:A中Co、O原子数目之比为1:4×1/2=1:2,符合,B中Co、O原子数目之比为(1+4×1/4):4=1:2,符合,C中Co、O原子数目之比为4×1/4:4×1/2=1:2,符合,D中Co、O原子数目之比为1:4×1/4=1:1,不符合,故选D。(4)钴原子填在氧原子的正八面体的空隙里,钴原子与跟它次近邻的氧原子之间的距离为
;(2)①氮的3P处于半充满状态,第一电离能N大于O;两种配位原子的杂化轨道类型均为sp3 ;②钴离子周围上下左右前后位置有氧原子,配位键数目(配位数)是6;氮形成3个δ键,sp2杂化,N03-的空间构型为平面(正)三角形 ;③已知Br的含氧酸酸性由强到弱的顺序为HBrO4>HBrO3>HBrO2>HBrO,其原因是含氧酸的中心元素 相同时,非羟基氧越多,中心元素的正电性越高,导致Br-O-H中的O的电子向Br偏移,在水分子作用下也就越易电离H+;(3)CoO2的重复结构单元示意图中Co、O原子数目之比应为1:2,由图象可知:A中Co、O原子数目之比为1:4×1/2=1:2,符合,B中Co、O原子数目之比为(1+4×1/4):4=1:2,符合,C中Co、O原子数目之比为4×1/4:4×1/2=1:2,符合,D中Co、O原子数目之比为1:4×1/4=1:1,不符合,故选D。(4)钴原子填在氧原子的正八面体的空隙里,钴原子与跟它次近邻的氧原子之间的距离为![]() pm;每个晶胞中含有的Co原子为:8×1/8+6×1/2=4,O为12×1/4+1=4,4个Co和O原子的体积为
pm;每个晶胞中含有的Co原子为:8×1/8+6×1/2=4,O为12×1/4+1=4,4个Co和O原子的体积为![]() ×4,晶胞的体积:(2a+2b)3,在该钴的氧化物品体中原子的空间利用率为
×4,晶胞的体积:(2a+2b)3,在该钴的氧化物品体中原子的空间利用率为![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步: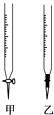
A.检查滴定管是否漏水
B.用蒸馏水洗干净滴定管
C.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
D.用待测定的溶液润洗酸式滴定管
E.用酸式滴定管取稀盐酸20.00mL,注入锥形瓶中,加入酚酞
F.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
G.另取锥形瓶,再重复操作一次
完成以下填空:
(1)操作F中应该选择图中 滴定管(填标号)。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察 。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
滴定终点溶液颜色的变化是 .若指示剂改为甲基橙则颜色的变化是 。
(3)滴定结果如表所示:
滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | ||
滴定前刻度 | 滴定后刻度 | |||
① | 20 | 1.02 | 21.03 | |
② | 20 | 2.00 | 25.00 | |
③ | 20 | 0.60 | 20.59 | |
滴定中误差较大的是第 次实验,造成这种误差的可能原因是 。
A.碱式滴定管在装液前未用标准NaOH溶液润洗2~3次
B.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C.滴定开始前碱式滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D.达到滴定终点时,仰视溶液凹液面最低点读数
E.滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
(4)该盐酸的浓度为mol/L。
【题目】请完成下列问题
(1)已知红磷比白磷稳定,则反应
P4(白磷,s)+5O2(g)═2P2O5(s)△H1;
4P(红磷,s)+5O2(g)═2P2O5(s)△H2;
△H1和△H2的关系是△H1△H2(填“>”、“<”)
(2)由N2O和NO反应生成1mol N2和NO2的能量变化如图所示,请写出该反应的热化学方程式
(3)在298K、101kPa时,已知:
①2H2O(g)═O2(g)+2H2(g)△H1;
②Cl2(g)+H2(g)═2HCl(g)△H2;
③2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3 ,
则△H3与△H1和△H2之间的关系正确的是 .
A.△H3=△H1+2△H2
B.△H3=△H1+△H2
C.△H3=△H1﹣2△H2
D.△H3=△H1﹣△H2
(4)已知H2(g)+Br2(g)═2HBr(g)△H=﹣72kJmol﹣1 , 相关键能数据如表:
物质 | H2(g) | Br2(g) | HBr(g) |
1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
则表中a= .
【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2L的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法正确的是( )
A. 该反应进行到第3分钟时,逆反应速率大于正反应速率
B. 若要提高SO2的转化率,可用空气代替纯氧气并鼓入过量空气
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01mol/(L·min)
D. 容器内达到平衡状态时的压强与起始时的压强之比为5∶4