题目内容
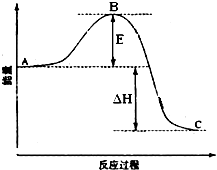 2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.请回答下列问题:(1)图中A、C分别表示
反应物总能量、
反应物总能量、
、生成物总能量
生成物总能量
,(2)图中△H=
-198
-198
kJ?mol-1;(3)已知单质硫的燃烧热为296kJ?mol-1,计算由S(s)生成3mol SO3(g)的△H
=-1185kJ?mol-1.
=-1185kJ?mol-1.
(要求计算过程).分析:(1)根据A、C分别表示反应物总能量的生成物总能量;
(2)根据参加反应SO2的物质的量之比等于对应的△H之比;
(2)根据单质硫的燃烧热以及1mol SO2(g)氧化为1mol SO3的反应热利用盖斯定律来求;
(2)根据参加反应SO2的物质的量之比等于对应的△H之比;
(2)根据单质硫的燃烧热以及1mol SO2(g)氧化为1mol SO3的反应热利用盖斯定律来求;
解答:解:(1)因图中A、C分别表示反应物总能量、生成物总能量,故答案为:反应物总能量;生成物总能量;
(2)因1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1,所以2mol SO2(g)氧化为2mol SO3的△H=-198kJ?mol-1,
则2SO2(g)+O2(g)=2SO3(g)△H=-198kJ?mol-1,故答案为:-198;
(3)因单质硫的燃烧热为296kJ?mol-1,则S(s)+O2(g)=SO2(g)△H=-296kJ?mol-1,
而 1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1,则SO2(g)+
O2(g)=SO3(g)△H=-99kJ?mol-1,
由盖斯定律可得:S(s)+
O2(g)=SO3(g)△H=-296kJ?mol-1+(-99kJ?mol-1)=-395kJ?mol-1,
所以S(s)生成3mol SO3(g)的△H为-395kJ?mol-1×3=-1185 kJ?mol-1,
故答案为=-1185 kJ?mol-1.
(2)因1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1,所以2mol SO2(g)氧化为2mol SO3的△H=-198kJ?mol-1,
则2SO2(g)+O2(g)=2SO3(g)△H=-198kJ?mol-1,故答案为:-198;
(3)因单质硫的燃烧热为296kJ?mol-1,则S(s)+O2(g)=SO2(g)△H=-296kJ?mol-1,
而 1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1,则SO2(g)+
| 1 |
| 2 |
由盖斯定律可得:S(s)+
| 3 |
| 2 |
所以S(s)生成3mol SO3(g)的△H为-395kJ?mol-1×3=-1185 kJ?mol-1,
故答案为=-1185 kJ?mol-1.
点评:本题主要考查了反应过程的能量变化图以及运用盖斯定律进行反应热的计算,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2009?丹东模拟)请根据工业制硫酸的有关知识回答下列问题:
(2009?丹东模拟)请根据工业制硫酸的有关知识回答下列问题:

