题目内容
【题目】常温下,向20mL0.1mol/LHA溶液中滴加0.1mol/L的氨水,溶液的pH随氨水的体积关系如图所示。下列说法不正确的是
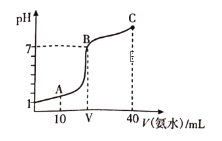
A. HA的电离方程式为HA=H++A-
B. B点时加入HA和氨水恰好完全反应
C. A点所示溶液中:c(A-)=2c(NH4+)+2c(NH3·H2O)
D. C点所示溶液中:c(NH4+)>c(A-)>c(NH3·H2O)
【答案】B
【解析】
根据图象可知,0.1mol/L的HA的pH=1,则c(H+)=0.1mol/L,与HA的浓度相等,HA为强酸。
A. 据分析可知HA为一元强酸,则其电离方程式为HA=H++A-,故A正确;
B. 加入HA和氨水恰好完全反应时,生成NH4A,为强酸弱碱盐,溶液显酸性,B点时溶液呈中性,故B错误;
C. A点时溶液为HA、NH4A,且物质的量相等,根据物料守恒,溶液中:c(A-)=2c(NH4+)+2c(NH3·H2O),故C正确;
D. C点时溶液为NH3·H2O、NH4A,且物质的量相等,溶液呈碱性,氨水的电离程度大于铵根离子的水解程度,则溶液中:c(NH4+)>c(A-)>c(NH3·H2O),故D正确;
答案为B。

【题目】硼(B)及其化合物在化学工业中有诸多用途,请回答下列问题:
(1)硼氢化钠(NaBH4)是硼的重要化合物。
①NaBH4中B的化合价为_______________。
②工业上可利用硼酸甲酯[B(OCH3)3]与氢化钠(NaH)反应制备NaBH4反应的另种产物为甲醇钠(CH3ONa),该反应的化学方程式为______________________。
③NaBH4与水反应生成NaBO2和H2,该反应生成的氧化产物与还原产物的物质的量之比为____________________。
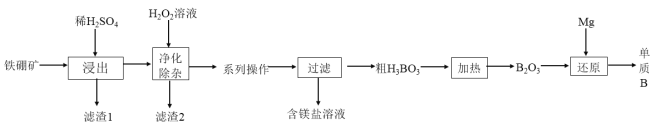
(2)工业上以铁硼矿(主要成分为Mg2B2O5H2O,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备单质B的工艺流程如图所示:
已知:相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ |
开始沉淀的pH | 2.7 | 3.7 | 5.8 | 9.6 |
完全沉淀的pH | 3.7 | 4.7 | 8.8 | 11 |
请回答下列问题:
①“浸出”时.将铁硼矿石粉碎的目的为___________________________。写出Mg2B2O5H2O与硫酸反应的化学方程式:____________________。
②滤渣1的主要成分为_____________________________。
③“净化除杂”时需先加H2O2溶液,其目的为_______________,然后再调节溶液的pH≈5,其目的是___________________________________。
④制得的粗硼在一定条件下能生成BI3 , BI3加热分解可以得到纯净的单质硼。现将0.025 g粗硼制成的BI3完全分解,生成的I2用0.30 molL-1 Na2S2O3溶液滴定(I2 +2S2O32-=2I-+ S4O6 2-)至终点,消耗 18.00 mLNa2S2O3溶液:盛装Na2S2O3溶液应用_____________填“酸式”或“碱式”)滴定管,该粗硼样品的纯度为________________。