��Ŀ����
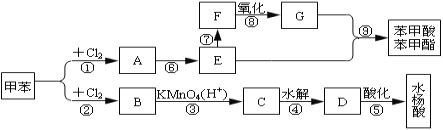
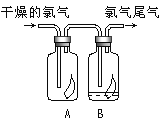
����Ŀ����1��������ʵ�����Ʒ��Ļ�ѧ����ʽΪ________����ͼ��ʾ������������ͨ��ʢ�и�����ɫ�����Ĺ��ƿA��ʢ�г�ʪ��ɫ�����Ĺ��ƿB���ɹ۲쵽��������______��
��2����ҵ�ϳ������۵�ʯ�������չ�ҵ����β���Ƶ�Ư�ۣ�����¶���ڿ����е�Ư�ۣ���ϡ����������������_________������ĸ�������
A��O2 B��Cl2 C��CO2 D��HClO
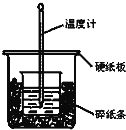
��3��ʵ��������ͼ��ʾװ����ȡ�������ռ�����Ӧʹ��___�������Ⱥ�պ��Ũ����IJ������������ܿ�,������������________��Ҫ�õ�����İ�����ѡ��___���������������������ø�װ����ȡ�ij���������_______��
���𰸡�MnO2+4HCl(Ũ)![]() MnCl2+Cl2+2H2O ������ɫ��������������ʪ��ɫ������ɫ C �����ſ��� �������� ��ʯ�� ����
MnCl2+Cl2+2H2O ������ɫ��������������ʪ��ɫ������ɫ C �����ſ��� �������� ��ʯ�� ����
��������
��1��ʵ�����Ʊ�����������MnO2��Ũ���ᷴӦ������Ӧ����ʽΪMnO2��4HCl(Ũ) ![]() MnCl2��Cl2����2H2O���������������ʹ�������ɫ������ɫ����ʹʪ�����ɫ������ɫ��
MnCl2��Cl2����2H2O���������������ʹ�������ɫ������ɫ����ʹʪ�����ɫ������ɫ��
��ΪMnO2��4HCl(Ũ) ![]() MnCl2��Cl2����2H2O��������ɫ��������������ʪ��ɫ������ɫ��
MnCl2��Cl2����2H2O��������ɫ��������������ʪ��ɫ������ɫ��
��2��Ư�۵ijɷ���CaCl2��Ca(ClO)2����Ч�ɷ���Ca(ClO)2����Ϊ̼�������ǿ��HClO��Ư�۳��ڷ����ڿ���������Ca(ClO)2��CO2��H2O=CaCO3����2HClO��HClO����ֽ��ΪHCl��O2�������������CaCO3��2HCl=CaCl2��CO2����H2O������������ΪCO2��ѡ��C��ȷ��
��ΪC��
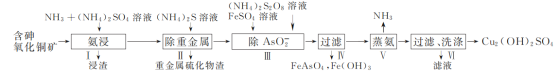
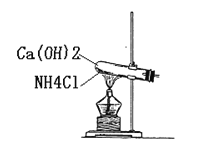
��3����Ϊ������������ˮ����˲����ſ������ռ����������ܶ�С�ڿ��������������ſ������ռ���Ũ������лӷ��ԣ����߷���NH3��HCl=NH4Cl��NH4ClΪ���壬�������Dz������̣�ʵ���Ҹ��ﰱ�������ü�ʯ�ң���װ��Ϊ���士����![]() ���壬�������ø�װ���Ʊ�������
���壬�������ø�װ���Ʊ�������
��Ϊ�����ſ������������̣���ʯ�ң�������