题目内容
12 g含有2种化合物(由常见主族的短期元素组成)的白色固体溶于过量的盐酸,放出2.94 L某种气体(标准状况),气体密度为同温同压下空气密度的1.52倍;剩余的不溶性残渣含氧53.3%,既不溶于水,常温下又不易与稀碱溶液反应。通过计算分析这两种化合物可能是什么物质(请至少分析出两组合理的正确答案)。
解析:
| 因为M气=1.52X29=44,所以混合物溶于盐酸产生的气体是CO2,n(CO2)=2.94L/22.4 L·mol-1=0.13mol。由此分析得原两种化合物中,有一种是碳酸盐或碳酸氧盐,依题意写一种不溶物质是SiO2。
如果是MgCO3:0.131X84=11.08<12g,符合题意;如果是Na2CO3:0.131X106=13.9 g>12 g,不符合题意。 依照此推论:NaHCO3,NH4HCO3,Mg(HCO3)2均符合题意。
|

高纯度单晶硅是典型的无机非金属材料,是制备半导体的重要材料,它的发现和使用曾引起计算机的一场“革命”。高纯硅通常用以下方法制备:用碳在高温下还原二氧化硅制得粗硅(含Fe、Al、B、P等杂质),粗硅与氯气反应生成四氯化硅(反应温度为450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置图。

相关信息:a.四氯化硅遇水极易水解;b.硼、铝、铁、磷在高温下均能与氯气直接化合生成相应的氯化物;c.有关物质的物理常数见下表:
|
物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
|
沸点/℃ |
57.7 |
12.8 |
— |
315 |
— |
|
熔点/℃ |
-70.0 |
-107.2 |
— |
— |
— |
|
升华温度/℃ |
— |
— |
180 |
300 |
162 |
请回答下列问题:
(1)仪器e的名称为 ,装置A中f管的作用是 ,其中发生反应的离子方程式为 。
(2)装置B中的试剂是 。
(3)某学习小组设计了以下两种实验方案:方案甲:g接装置Ⅰ;方案乙:g接装置Ⅱ。但是甲乙两个方案中虚线内装置均有不足之处,请你评价后填写下表。
|
方案 |
不足之处 |
|
甲 |
|
|
乙 |
|
(4)在上述(3)的评价基础上,请设计一个合理方案: 。
(5)通过上述合理的装置制取并收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是 (填写元素符号)。
高纯度单晶硅是典型的无机非金属材料,是制备半导体的重要材料,它的发现和使用曾引起计算机的一场“革命”。高纯硅通常用以下方法制备:用碳在高温下还原二氧化硅制得粗硅(含Fe、Al、B、P等杂质),粗硅与氯气反应生成四氯化硅(反应温度为450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置图。

相关信息:a.四氯化硅遇水极易水解;b.硼、铝、铁、磷在高温下均能与氯气直接化合生成相应的氯化物;c.有关物质的物理常数见下表:
|
物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
|
沸点/℃ |
57.7 |
12.8 |
— |
315 |
— |
|
熔点/℃ |
-70.0 |
-107.2 |
— |
— |
— |
|
升华温度/℃ |
— |
— |
180 |
300 |
162 |
请回答下列问题:
(1)仪器e的名称为____________,装置A中f管的作用是_______________________________________,其中发生反应的离子方程式为_____ ____________________________________ _______。
(2)装置B中的试剂是____________。
(3)某学习小组设计了以下两种实验方案:方案甲:g接装置Ⅰ;方案乙:g接装置Ⅱ。但是甲乙两个方案中虚线内装置均有不足之处,请你评价后填写下表。
|
方案 |
不足之处 |
|
甲 |
|
|
乙 |
|
(4)在上述(3)的评价基础上,请设计一个合理方案:___________ ________ 。
(5)通过上述合理的装置制取并收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是 (填写元素符号)。
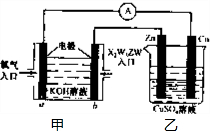 已知X、Y、Z、W四种短周期元素的原子半径依次减小.在周期表中X与Y、Y与Z均位同一周期的相邻位置;X的最外层电子数为次外层电子数的2倍;W分别能与X、Y、Z按一定原子数比形成电子总数为10的常见化合物.请判断X、Y、Z、W四种元素并回答下列问题:(要求用确定后的元素符号及有关化学用语表示)
已知X、Y、Z、W四种短周期元素的原子半径依次减小.在周期表中X与Y、Y与Z均位同一周期的相邻位置;X的最外层电子数为次外层电子数的2倍;W分别能与X、Y、Z按一定原子数比形成电子总数为10的常见化合物.请判断X、Y、Z、W四种元素并回答下列问题:(要求用确定后的元素符号及有关化学用语表示)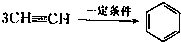 三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式:
三聚氰胺也可以由氰胺(WXY分子中的W原子被氨基取代后可得氰胺)发生类似于乙炔的三聚反应而得到,三聚氰胺中无非极性键,含有量个氨基.请写出三聚氰胺结构简式: