题目内容
若在标准状况下,将H2和O2组成的混合气体点燃爆炸后,再恢复到标准状况,气体体积减少33.6L,计算反应过程中放出的热量是多少?
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:标准状况下,2H2(g)+O2(g)═2H2O(l)△H=-572kJ?mol-1,根据气体体积差量法可以计算混合气体中氢气的体积,根据氢气的量来计算反应放出的热量多少.
解答:
解:设混合气体中氢气的物质的量是n,气体体积比原来减少了33.6L(折合成标准状况下的体积)n=
=
=1.5mol,则
2H2(g)+O2(g)═2H2O(l)气体体积减小量
2 1 3
n 1.5mol
=
,解得n=1mol,根据热化学方程式2H2(g)+O2(g)═2H2O(l);△H=-572kJ?mol-1的含义,2mol氢气燃烧生成液态水放出的热量是572kJ,所以1mol氢气燃烧放出的热量是286kJ,
答:反应过程中放出的热量是286kJ.
| V |
| Vm |
| 33.6L |
| 22.4L/mol |
2H2(g)+O2(g)═2H2O(l)气体体积减小量
2 1 3
n 1.5mol
| 2 |
| n |
| 3 |
| 1.5 |
答:反应过程中放出的热量是286kJ.
点评:本题主要考查了反应热的计算,掌握热化学方程式的含义以及气体体积差量法的计算方法是解答的关键,题目难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
下列反应中,不能产生乙酸的是( )
| A、乙醛催化氧化 |
| B、乙酸钠与盐酸作用 |
| C、乙酸乙酯在酸性条件下水解 |
| D、乙酸乙酯在碱性条件下水解 |
下列化学用语使用正确的组合是( )
A、乙炔的分子结构模型示意图: |
| B、二硫化碳的结构式:S═C═S |
C、NH4Cl的电子式: |
D、2-甲基丁醇的结构简式: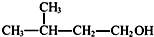 |
M元素的一个原子失去两个电子转移到N元素的两个原子中形成化合物Z,下列说法不正确的是( )
| A、M元素的离子可表示为M2+ |
| B、Z化学式可表示为MN2 |
| C、Z一定能溶于水 |
| D、Z一定为离子化合物 |

 (1)已知:①Mg(s)+Cl2(g)=MgCl2(s)△H=-641kJ?mol-1.
(1)已知:①Mg(s)+Cl2(g)=MgCl2(s)△H=-641kJ?mol-1.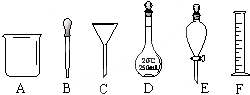 有如图A~F六种仪器:
有如图A~F六种仪器: