题目内容
【题目】(1)向1molL﹣1的Na2CO3溶液中加酚酞试液,观察到的现象是_____,原因是(离子方程式表示)_____。再向溶液中滴入过量的氯化钙溶液,观察到的现象_____,原因是(用离子方程式表示和必要的语言说明)_____
(2)某学生用中和滴定法测定某NaOH溶液的物质的量浓度,选酚酞作指示剂用盐酸滴定待测液NaOH,判断滴定终点时的方法是______;若滴定前平视读数,滴定终点时俯视读数,则会使所测NaOH溶液的浓度值_____(填“无影响”、“偏高”或“偏低”)
(3)某温度下,纯水的c(H+)=3×10﹣7mol/L,Na2S和NaOH两溶液的pH均为12,则两溶液中由水电离出的c(OH﹣)的比值为______。
(4)加热蒸干并灼烧AlCl3溶液的产物是______;加热蒸干并灼烧FeCl2溶液的产物是______
【答案】溶液变红 CO32﹣+H2O HCO3﹣+OH﹣ 溶液褪色、有白色沉淀生成 Ca2++CO32﹣=CaCO3↓使水解平衡逆向移动,溶液的碱性减弱 当滴加最后一滴标准液时,溶液由红色变为无色,且30s不复色 偏低 9×1010 Al2O3 Fe2O3
【解析】
(1) 向1molL-1的Na2CO3溶液水解呈碱性,溶液变红,再向溶液中滴入过量的氯化钙溶液,钙离子与碳酸根离子结合形成难溶的碳酸钙,导致碳酸根离子浓度减小,平衡逆向移动;
(2) 根据滴定终点,锥形瓶中的溶液颜色发生变化,且30s内不恢复;根据c(待测)=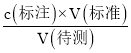 分析不当操作对V(标准)的影响,以此判断浓度的误差;
分析不当操作对V(标准)的影响,以此判断浓度的误差;
(3) NaOH抑制水的电离,Na2S促进水的电离,可根据pH计算水的电离,以此解析;
(4) AlCl3溶液在加热时水解生成Al(OH)3,Al(OH)3在加热条件下分解生成Al2O3;氯化铁水解生成氢氧化铁和氯化氢,FeCl3+3H2OFe(OH)3+3HCl,加热过程中促进氯化氢挥发,从而促进氯化铁水解,最后蒸干时得到氢氧化铁固体,氢氧化铁灼烧得到固体氧化铁。
(1) 在1molL﹣1的Na2CO3溶液中CO32-的水解使溶液显碱性,发生的水解反应式为CO32-+H2OHCO3-+OH-,滴加酚酞试液,溶液变红,再向溶液中滴入过量的氯化钙溶液,钙离子与碳酸根离子结合形成难溶的碳酸钙白色沉淀,发生的离子反应式为Ca2++CO32-=CaCO3↓,导致CO32-浓度减小,平衡逆向移动,OH-浓度减小,溶液褪色;
(2) 用盐酸滴定氢氧化钠溶液以酚酞作指示剂,终点现象是当滴加最后一滴标准液时,溶液由红色变为无色,且30s不复色;若滴定前平视读数,滴定终点时俯视读数,造成V(标准)偏小,根据c(待测)=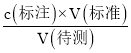 ,可知c(标准)偏低;
,可知c(标准)偏低;
(3) 在测得pH都等于12的NaOH溶液和Na2S溶液中,NaOH溶液由水电离的OH-浓度为=10-12mol/L,Na2S溶液由水电离的OH-浓度为=![]() =9×10-2mol/L,故两者比值为9×10-2:10-12mol=9×1010;
=9×10-2mol/L,故两者比值为9×10-2:10-12mol=9×1010;
(4) AlCl3溶液在加热时水解生成Al(OH)3,生成的HCl易挥发,最终生成Al(OH)3,在加强热时,Al(OH)3不稳定,分解生成Al2O3;氯化铁水解生成氢氧化铁和氯化氢,FeCl3+3H2OFe(OH)3+3HCl,加热过程中促进氯化氢挥发,从而促进氯化铁水解,最后蒸干时得到氢氧化铁固体,灼烧时氢氧化铁固体分解生成Fe2O3,所以最后得到的固体是Fe2O3。

 名师点拨卷系列答案
名师点拨卷系列答案