题目内容
需加入适当的还原剂才能实现的反应是( )
| A、PCl3→PCl5 |
| B、MnO2→Mn2+ |
| C、SO2→SO2-3 |
| D、Fe→Fe2O3 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:需加入适当的还原剂才能实现,说明物质具有氧化性,在反应中得电子,所含元素的化合价降低,以此解答该题.
解答:
解:A.P元素化合价升高,被氧化,应加入氧化剂,故A错误;
B.Mn元素化合价降低,被还原,应加入还原剂才能实现,故B正确;
C.S元素化合价没有发生变化,不是氧化还原反应,故C错误;
D.Fe元素化合价升高,被氧化,应加入氧化剂才能实现,故D错误.
故选B.
B.Mn元素化合价降低,被还原,应加入还原剂才能实现,故B正确;
C.S元素化合价没有发生变化,不是氧化还原反应,故C错误;
D.Fe元素化合价升高,被氧化,应加入氧化剂才能实现,故D错误.
故选B.
点评:本题考查氧化还原反应,侧重于学生的分析能力和基本概念的理解和应用,难度不大,注意从元素化合价的角度分析,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
 如图为含有同一种元素的a、b、c、d、e五种物质的转化关系.其中a是单质,b是气态氢化物,c、d是氧化物,e是该元素最高价氧化物对应的水化物,则a可能是( )
如图为含有同一种元素的a、b、c、d、e五种物质的转化关系.其中a是单质,b是气态氢化物,c、d是氧化物,e是该元素最高价氧化物对应的水化物,则a可能是( )①C ②N2 ③S ④F2.
| A、只有①和③ | B、只有④ |
| C、①②③ | D、①②③④ |
在下列三个实验中:①配制一定物质的量浓度的溶液 ②蒸发 ③过滤,均要用到的仪器是( )
| A、试管 | B、胶头滴管 |
| C、玻璃棒 | D、漏斗 |
下列反应中,不属于氧化还原反应的是( )
| A、Zn+2HCl=ZnCl2+H2↑ | ||||
| B、Na2CO3+CaCl2=CaCO3↓+2NaCl | ||||
C、2H2O
| ||||
| D、H2+Cl2=2HCl |
下列过程所包含的有机化学反应中,不属于氧化反应的是( )
| A、烯烃使酸性高锰酸钾溶液褪色 |
| B、在家中燃烧液化石油气做饭 |
| C、乙酸与乙醇反应生成乙酸乙酯 |
| D、用装有酸性重铬酸钾的装置检验司机是否酒后驾车 |
 设nA为阿伏加德罗常数的值,下列叙述正确的是( )
设nA为阿伏加德罗常数的值,下列叙述正确的是( )| A、常温常压下,16g14CH4所含中子数目为8nA |
| B、标准状况下,22.4 LCCl4所含分子数目为nA |
| C、1 L 0.5 mol?L-1的CH3COONa溶液中所含的CH3COO-离子数目为0.5nA |
| D、6.2g白磷(分子式为P4,分子结构如图所示)所含P-键数目为0.3nA |
下列装置和操作能达到实验目的是( )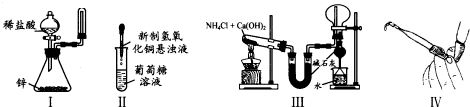

| A、实验I:制取并收集氢气 |
| B、实验II:验证葡萄糖的还原性 |
| C、实验III:实验室制氨气并收集干燥的氨气 |
| D、实验Ⅳ:检查碱式滴定管是否漏液 |
下列实验操作能够达到实验目的是( )
| A、用激光笔鉴别淀粉溶液和蔗糖溶液 |
B、 实验室采用如图所示装置收集SO2 实验室采用如图所示装置收集SO2 |
| C、除去NaHCO3溶液中的Na2CO3,可加入Ca(OH)2溶液后过滤 |
| D、配制一定物质的量浓度溶液时,容量瓶用蒸馏水洗涤后再用待装溶液润洗 |
 CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物.工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.
CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物.工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.