题目内容
5.海波(Na2S2O3•5H2O)常用手纺织和造纸工业,海波是无色透明的晶体,易溶于水,遇酸立即分解:S2O32-+2H+═S↓+SO2↑+H2O硫化碱法是工业上制备海波的方法之一,反应原理为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2某研究小组在实验室用硫化碱法制备Na2S2O3•5H2O,实验装置如图所示: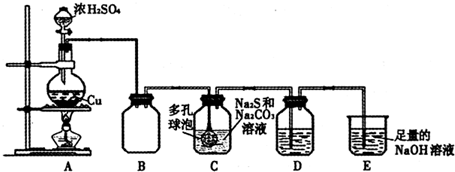
(1)装置A中滴加浓硫酸的仪器名称是分液漏斗,发生反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,实验室还可以用A装置制取的气体单质有Cl2(填化学式).
(2)装置C中连接多孔球泡可以提高S O2的吸收效率,其依据的原理是增大气体与溶液的接触面积.
(3)装置D的作用是检验装置C中SO2的吸收效率,D中的试剂可以是ad.
a.品红溶液 b.氢氧化钠溶液 c.酚酞溶液 d.酸性高锰酸钾溶液
(4)装置E的作用是吸收SO2,防止污染空气.
(5)实验制得的Na2S2O3•5H2O产品中可能含有Na2SO3、Na2SO4等杂质.请设计实验,检测Na2S2O3•5H2O产品中是否存在Na2SO4杂质,简要说明实验操作、现象和结论:取少量产品于试管中,先滴加过量的稀盐酸,静置,取上层清液,再加氯化钡,若出现白色沉淀,则说明Na2S2O3•5H2O产品中含有Na2SO4.
(6)Na2S2O3溶液是定量实验中的常用试剂,为了测定某K2Cr2O7溶液的浓度,研究小组的同学准确量取10.00mL K2Cr2O7溶液于锥形瓶中,加入过量KI固体和适量的稀H2SO4,滴加指示剂,用0.1000mol•L-1 Na2S2O3标准溶液滴定至终点,3次平行实验测得平均消耗Na2S2O3溶液的体积为30.00mL,则c(K2Cr2O7)=0.0500mol•L-1.(已知:Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O,2S2 62-+I2═S4O62-+2I-)
分析 (1)根据仪器的结构特点判断;在加热条件下,Cu与浓硫酸反应生成硫酸铜、二氧化硫和水;该装置为固液加热型装置;
(2)使用多孔的球泡可以增大气体与溶液的接触面积;
(3)用D装置检验二氧化硫是否被完全吸收,根据二氧化硫的还原性和漂白性分析;
(4)二氧化硫为有毒的酸性气体;
(5)检验硫酸根离子时选用盐酸和氯化钡溶液;
(6)根据Na2S2O3的量求出I2,再根据K2Cr2O7与I2的关系求出K2Cr2O7的物质的量及浓度.
解答 解:(1)根据仪器的结构特点可知,装置A中滴加浓硫酸的仪器名称是分液漏斗;在加热条件下,Cu与浓硫酸反应生成硫酸铜、二氧化硫和水,其反应的方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;该装置为固液加热型装置,浓盐酸与二氧化锰在加热条件下反应制备Cl2可以使用该装置;
故答案为:分液漏斗;Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;Cl2;
(2)多孔的球泡可以增大气体与溶液的接触面积,使气体被充分吸收,有利于提高实验的准确度,故答案为:增大气体与溶液的接触面积;
(3)用D装置检验二氧化硫是否被完全吸收,因为二氧化硫的还原性可以使酸性高锰酸钾溶液褪色,所以可以选用酸性高锰酸钾溶液,
二氧化硫具有漂白性可以使品红褪色,所以可以选用品红;
二氧化碳通入氢氧化钠溶液和酚酞溶液无明显现象;
故答案为:ad;
(4)二氧化硫为有毒的酸性气体,最后要用氢氧化钠溶液来吸收,防止污染空气,故答案为:吸收SO2,防止污染空气;
(5)检测Na2S2O3•5H2O产品中是否存在Na2SO4杂质,先加过量的稀盐酸排除干扰,静置,取上层清液,再加氯化钡,若出现白色沉淀,说明溶液中含有硫酸根离子,即Na2S2O3•5H2O产品中含有Na2SO4;
故答案为:取少量产品于试管中,先滴加过量的稀盐酸,静置,取上层清液,再加氯化钡,若出现白色沉淀,则说明Na2S2O3•5H2O产品中含有Na2SO4;
(6)10.00mL K2Cr2O7溶液于锥形瓶中,加入过量KI固体和适量的稀H2SO4,反应生成I2,用0.1000mol•L-1 Na2S2O3标准溶液滴定至终点,3次平行实验测得平均消耗Na2S2O3溶液的体积为30.00mL,则n(Na2S2O3)=cV=0.1000mol•L-1×0.0300L=0.00300mol,
已知:Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O,2S2O32-+I2═S4O62-+2I-,
Cr2O72-~~~3I2~~~6S2O32-
1mol 6mol
n 0.00300mol
则n(K2Cr2O7)=0.000500mol
所以c(K2Cr2O7)=$\frac{0.000500mol}{0.01L}$=0.0500mol/L;
故答案为:0.0500.
点评 本题以硫的化合物的性质为载体,考查了物质的制备方案设计、氧化还原滴定的应用、实验基本操作、化学计算等,难度中等,是对知识的综合运用与分析解决问题能力的考查,注意利用关系式进行计算.

| A. | 1s | B. | 2d | C. | 3p | D. | 4f |
| A. | 120吨 | B. | 117.6吨 | C. | 116吨 | D. | 121吨 |
| A. | 天然气、液化石油气、沼气的主要成分均为甲烷 | |
| B. | 煤中含有苯、甲苯及多种化工原料,可通过煤的干馏获得 | |
| C. | 石油主要是各种烷烃、环烷烃、烯烃组成的混合物 | |
| D. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 |
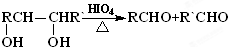
 ;
;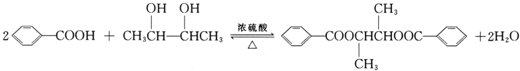 ;
;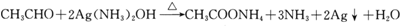 .
.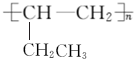 .
.
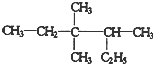 3,3,4-三甲基已烷
3,3,4-三甲基已烷 、
、 .
. ,则其分子式为C10H16,该烃的一溴取代物有2种.
,则其分子式为C10H16,该烃的一溴取代物有2种. .
.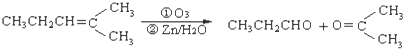 上述反应可用来推断烃分子中碳碳双键的位置.某烃A的分子式为C6H10,经过上述转化生成
上述反应可用来推断烃分子中碳碳双键的位置.某烃A的分子式为C6H10,经过上述转化生成 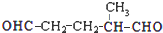 ,则烃A的结构可表示为
,则烃A的结构可表示为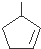 .
.