题目内容
7.下列关于化合物A(结构简式如图)的叙述中正确的是( )
| A. | 分子中只有极性键 | B. | 分子中有σ键和π键 | ||
| C. | 该分子中三种元素的电负性:H>C>0 | D. | 该分子在水中的溶解度小于甲烷的 |
分析 A.C、H与C、O之间形成极性键,而C、C之间形成非极性键;
B.双键中含1个σ键和1个π键,单键均为σ键;
C.非金属性越强,元素的电负性越大;
D.甲烷不溶于水,而该物质属于烯醛类物质.
解答 解:A.C、H与C、O之间形成极性键,而C、C之间形成非极性键,则分子中既有极性键又有非极性键,故A错误;
B.双键中含1个σ键和1个π键,故该分子中有σ键和π键,故B正确;
C.非金属性越强,元素的电负性越大,氧的非金属性强于氢碳,碳的非金属性强于氢,所以元素电负性:O>C>H,故C错误;
D.甲烷不溶于水,而该物质属于烯醛类物质,可溶于水,则该分子在水中的溶解度大于甲烷,故D错误,
故选:B.
点评 本题考查化学键,为高频考点,把握物质中的化学键及共价键类型等为解答的关键,注重基础知识的考查,注意-CHO的性质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列物质属于电解质的是( )
| A. | 稀盐酸 | B. | 二氧化碳 | C. | 酒精 | D. | 硫酸钡 |
15.下列化学方程式或离子方程式正确的是( )
| A. | 甲醛溶液中加入足量的银氨溶液并加热:HCHO+2[Ag(NH3)2]++2OH-$\stackrel{△}{→}$HCOO-+NH4++2Ag↓+3NH3+H2O | |
| B. | 乙醇溶液中加入新制碱性Cu(OH)2悬浊液并加热:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O | |
| C. | 乙醇和浓硫酸混合加热至140℃:CH3CH2OH$→_{140℃}^{浓硫酸}$CH2=CH2↑+H2O | |
| D. | 向小苏打溶液中加入醋酸:CO32-+2CH3COOH=CO2↑+H2O+2CH3COO- |
2.下列各组物质中,仅用水及物质间相互反应不能一一区别的一组是( )
| A. | Na2O2 Al2(SO4)3 MgCl2 K2CO3 | |
| B. | BaCl2 Na2SO4 (NH4)2SO4 KOH | |
| C. | AgNO3 NaCl KCl CuCl2 | |
| D. | Fe2(SO4)3 K2CO3 KHSO4 NH4Cl |
12.下列解释事实的方程式正确的是( )
| A. | 电解饱和食盐水,产生黄绿色气体:2NaCl+2H2O═2NaOH+H2↑+Cl2↑ | |
| B. | 用Na2CO3溶液将水垢中的CaSO4转化为CaCO3:CO32-+Ca2+═CaCO3↓ | |
| C. | 向H2O2溶液中滴加CuSO4溶液,产生气泡:H2O2═H2O+O2↑ | |
| D. | 向苯酚浊液中滴加Na2CO3溶液,溶液变澄清: |
19.下列现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | Na2CO3•10H2O晶体久置后变成白色粉末 | Na2CO3•10H2O与空气中的CO2作用生成 NaHCO3 |
| B | 青铜(铜锡合金)在空气中久置表面会生成一层铜绿 | 发生电化学腐蚀,铜做负极 |
| C | 将过量SO2通入到KMnO4溶液中,溶液褪色 | SO2具有还原性,与 KMnO4发生氧化还原反应 |
| D | 向含有酚酞的 Na2CO3溶液中加入BaCl2固体, 溶液红色变浅 | Na2CO3溶液中的电离平衡发生移动 |
| A. | A | B. | B | C. | C | D. | D |
16.下列化学用语正确的是( )
| A. | Zn的电子排布式:1s22s22p63s23p64s2 | |
| B. | Fe2+的电子排布式:[Ar]3d6 | |
| C. | C的价电子轨道表示式: | |
| D. | HClO的电子式: |
17.实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是( )
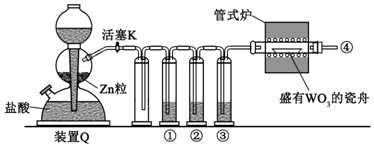

| A. | ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液 | |
| B. | 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体浓度 | |
| C. | 结束反应时,先关闭活塞K,再停止加热 | |
| D. | 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气 |