题目内容
下列过程需要增大化学反应速率的是( )。
| A.钢铁腐蚀 | B.食物腐败 |
| C.塑料老化 | D.工业合成氨 |
D
解析

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案
相关题目
下列各组反应(表内物质均为反应物)刚开始时,放出H2的速率最大的是
| 编号 | 金属(粉末状) | 酸的浓度 | 酸的体积 | 反应温度 |
| A | 0.1mol Mg | 6mol/L硝酸 | 10mL | 30℃ |
| B | 0.1mol Mg | 3mol/L盐酸 | 10mL | 60℃ |
| C | 0.1mol Fe | 3mol/L盐酸 | 10mL | 60℃ |
| D | 0.1mol Mg | 3mol/L盐酸 | 10mL | 30℃ |
在25 ℃、1.01×105 Pa下,反应2N2O5(g) 4NO2(g)+O2(g) ΔH="+56.7" kJ·mol-1能自发进行的合理解释是( )
4NO2(g)+O2(g) ΔH="+56.7" kJ·mol-1能自发进行的合理解释是( )
| A.该反应是分解反应 |
| B.该反应的熵增效应大于焓变效应 |
| C.该反应是熵减反应 |
| D.该反应是放热反应 |
已知反应:A+3B 2C+D,在某一段时间内以A的浓度变化表示的化学反应速率为1 mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为( )
2C+D,在某一段时间内以A的浓度变化表示的化学反应速率为1 mol·L-1·min-1,则此段时间内以C的浓度变化表示的化学反应速率为( )
| A.0.5 mol·L-1·min-1 | B.1 mol·L-1·min-1 |
| C.2 mol·L-1·min-1 | D.3 mol·L-1·min-1 |
在容积为2 L的密闭容器中充入2 mol SO2和一定量O2,发生反应2SO2+O2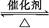 2SO3,当反应进行到4 min时,测得n(SO2)="0.4" mol。若反应进行到2 min末时,容器中SO2的物质的量是( )
2SO3,当反应进行到4 min时,测得n(SO2)="0.4" mol。若反应进行到2 min末时,容器中SO2的物质的量是( )
| A.等于1.6 mol | B.等于1.2 mol | C.大于1.6 mol | D.小于1.2 mol |
在2NO2(红棕色) N2O4(无色)的可逆反应中,下列状态一定属于平衡状态的是( )。
N2O4(无色)的可逆反应中,下列状态一定属于平衡状态的是( )。
| A.N2O4和NO2的分子数比为1∶2 |
| B.N2O4和NO2的浓度相等 |
| C.平衡体系的颜色不再改变 |
| D.单位时间内有1 mol N2O4变为NO2的同时,有1 mol NO2变为N2O4 |
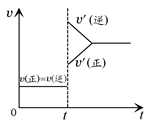
向一体积不变的密闭容器中充入H2和I2,发生反应H2(g)+I2(g) 2HI(g) ΔH<0,当达到平衡后,t1时刻改变反应的某一条件(混合气体总物质的量不变),造成容器内压强增大,则下列说法中正确的是 ( )
2HI(g) ΔH<0,当达到平衡后,t1时刻改变反应的某一条件(混合气体总物质的量不变),造成容器内压强增大,则下列说法中正确的是 ( )
| A.容器内气体的颜色变深,混合气体的密度增大 |
| B.平衡不发生移动 |
| C.I2(g)转化率增大,HI平衡浓度变小 |
| D.改变条件前后,速率图像如图所示 |
对于可逆反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是( )。
4NO(g)+6H2O(g),下列叙述正确的是( )。
| A.反应达到平衡时,若两种反应物的转化率相等,则起始投入的n(NH3)∶n(O2)=4∶5 |
| B.反应达到平衡时,对体系充入稀有气体并加压,平衡总是向逆反应方向移动 |
| C.反应达到平衡时,若向压强固定的密闭容器中充入稀有气体,平衡不移动 |
| D.当v正(NH3)∶v正(NO)=1∶1时,说明该化学反应已经达到平衡 |
