题目内容
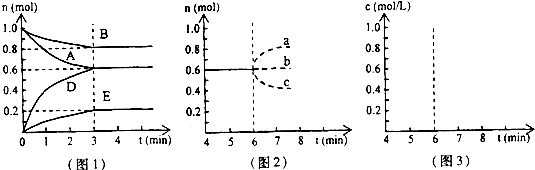
在某一容积为2L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示:
回答下列问题:
(1)该反应的化学方程式为______.
(2)前2min用A的浓度变化表示的化学反应速率为______mol?L-1?min-1.在2min时,图象发生改变的原因是______(用字母表示).
A.增大压强; B.降低温度
C.加入催化剂; D.增加A的物质的量.

回答下列问题:
(1)该反应的化学方程式为______.
(2)前2min用A的浓度变化表示的化学反应速率为______mol?L-1?min-1.在2min时,图象发生改变的原因是______(用字母表示).
A.增大压强; B.降低温度
C.加入催化剂; D.增加A的物质的量.

(1)达到平衡时A、B、C、D改变的物质的量分别为0.8mol、1.0mol、1.2mol、0.8mol,且A、B的物质的量减少,应为反应物;C、D的物质的量增加,应为生成物,故反应的化学方程式为4A+5B?6C+4D,
故答案为:4A+5B?6C+4D;
(2)前2min时,A的物质的量变化为:0.4mol;所以v(A)=
=0.1mol?L-1?min-1;从图象看,2~3min时图象的斜率变大,说明化学反应速率变快.增大压强、加入催化剂均增大化学反应速率,而降低温度减小化学反应速率.增加A的物质的量,虽能加快化学反应速率,但图象要产生突变,故A、C正确;
故答案为:0.1mol?L-1?min-1;AC.
故答案为:4A+5B?6C+4D;
(2)前2min时,A的物质的量变化为:0.4mol;所以v(A)=
| ||
| 2min |
故答案为:0.1mol?L-1?min-1;AC.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目

 pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).
pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).