题目内容
3.实验测得BeCl2为共价化合物,两个Be-Cl键间的夹角为180°,以下判断正确的是( )| A. | 由极性键构成的极性分子 | B. | 由极性键构成的非极性分子 | ||
| C. | 由非极性键构成的极性分子 | D. | BeCl2中Be采取sp2杂化 |
分析 共价化合物中,不同元素原子之间形成的化学键为极性键,同种元素原子之间形成的化学键为非极性键;正电荷中心与负电荷的中心重合为非极性分子,不重合为极性分子,据此判断.
解答 解:BeCl2中Be-Cl键是不同元素形成的共价键,为极性键,两个Be-Cl键间的夹角为180°,说明分子是对称的,正电荷中心与负电荷的中心重合,BeCl2属于非极性分子,故BeCl2由极性键形成的非极性分子,BeCl2中Be的价层电子对数=2+$\frac{1}{2}$(2-2×1)=2,为sp杂化,只有B正确.
故选B.
点评 本题考查化学键、分子极性判断、杂化类型的判断,题目比较基础,注意基础知识的理解掌握.

练习册系列答案
相关题目
13.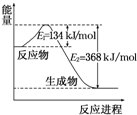 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
(1)如图是1mol NO2和1mol CO 反应生成 CO2和NO的过程中能量变化示意图,请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)═NO(g)+CO2(g);△H=-234 kJ•mol-1.
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)??2NH3(g);△H<0,其化学平衡常数K与T的关系如表所示:
请完成下列问题:
①试比较K1、K2的大小,K1>K2(填“>”、“=”或“<”).
②下列各项能作为判断该反应达到化学平衡状态依据的是c(填序号).
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v正(N2)=3v逆(H2)
c.容器内压强保持不变
d.混合气体的密度保持不变
③400℃时,反应2NH3(g)??N2(g)+3H2(g)的化学平衡常数K为2.当测得NH3、N2、H2的物质的量分别为3mol、2mol、1mol时,则该反应的v正(N2)>v逆(N2)(填“>”、“=”或“<”).
(3)氨气溶于水所得的溶液称为氨水.若某氨水的pH=12,则水电离出的c(OH-)=1×10-12mol•L-1,水的电离常数无影响(填“变大”、“变小”或“无影响”);在25℃下,向浓度均为0.1mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成Cu(OH)2沉淀(填化学式),生成该沉淀的离子方程式为2NH3•H2O+Cu2+=Cu(OH)2↓+2NH4+.(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)
 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:(1)如图是1mol NO2和1mol CO 反应生成 CO2和NO的过程中能量变化示意图,请写出NO2和CO反应的热化学方程式NO2(g)+CO(g)═NO(g)+CO2(g);△H=-234 kJ•mol-1.
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)??2NH3(g);△H<0,其化学平衡常数K与T的关系如表所示:
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
①试比较K1、K2的大小,K1>K2(填“>”、“=”或“<”).
②下列各项能作为判断该反应达到化学平衡状态依据的是c(填序号).
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v正(N2)=3v逆(H2)
c.容器内压强保持不变
d.混合气体的密度保持不变
③400℃时,反应2NH3(g)??N2(g)+3H2(g)的化学平衡常数K为2.当测得NH3、N2、H2的物质的量分别为3mol、2mol、1mol时,则该反应的v正(N2)>v逆(N2)(填“>”、“=”或“<”).
(3)氨气溶于水所得的溶液称为氨水.若某氨水的pH=12,则水电离出的c(OH-)=1×10-12mol•L-1,水的电离常数无影响(填“变大”、“变小”或“无影响”);在25℃下,向浓度均为0.1mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成Cu(OH)2沉淀(填化学式),生成该沉淀的离子方程式为2NH3•H2O+Cu2+=Cu(OH)2↓+2NH4+.(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20)
14.下列物质中属于纯净物的是( )
| A. |  稀盐酸 | B. |  冰水混合物 | C. |  食用醋 | D. |  液化石油气 |
18.混凝法是净化水常用的方法,在天然水或污水中加人一定的混凝剂,可使水中的悬浮物变为沉淀而除去.下列物质中可以作为混凝剂的是 ( )
| A. | 氯化钠 | B. | 氯气 | C. | 小苏打 | D. | 明矾 |
8.不同元素的原子(包括离子)( )
| A. | 质子数一定不等 | B. | 中子数一定不等 | ||
| C. | 质量数一定不等 | D. | 核外电子数一定不等 |
15.实验室中,从海带中提取I2的实验流程如图所示,下列说法不正确的是( )

| A. | 操作①用到的玻璃仪器有:烧杯、玻璃棒、漏斗 | |
| B. | 操作②中需加入氧化剂 | |
| C. | 可以用四氯化碳或酒精代替苯作萃取剂 | |
| D. | 蒸馏I2的苯溶液可获取I2并回收苯 |
13.下列说法正确的是( )
| A. | 分子式为CH4O和C2H6O的物质一定互为同系物 | |
| B. | 实验室制备硝基苯,将苯和浓硝酸混合后加热即可 | |
| C. | 棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O | |
| D. | 1mol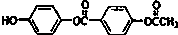 与足量的NaOH溶液加热充分反应,能消耗5molNaOH 与足量的NaOH溶液加热充分反应,能消耗5molNaOH |
 近年来太原市为建设“美丽太原”实施了一系列重要举措.
近年来太原市为建设“美丽太原”实施了一系列重要举措.

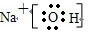 NH4Cl:
NH4Cl: CO2:
CO2: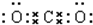 HClO:
HClO: NH3:
NH3: .
.