题目内容
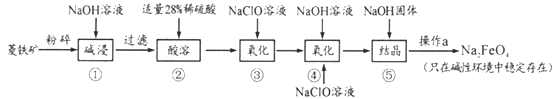
【题目】某工业废玻璃粉末含SiO2、Fe2O3、CeO2、FeO等。某课题小组设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵矾。
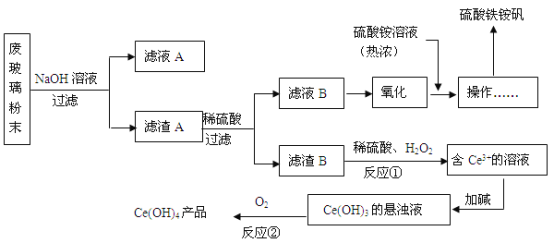
已知:CeO2不溶于稀硫酸;酸性条件下,Ce3+易水解,Ce4+有较强氧化性。
(1)硫酸铁铵矾可净水,其原理是(写离子方程式)________________________________。
(2)滤液A的主要成分_______________(填写化学式)。
(3)反应①的离子方程式是_____________________________。
(4)反应②的化学反应方程式是__________________________。
(5)已知制硫酸铁铵矾晶体[Fe2(SO4) 3·(NH4) 2SO4·24H2O,式量964]的产率为80%,若加入13.2g (NH4) 2SO4(式量132),可制得晶体的质量是_________。
(6)化合物HT可作为萃取剂能将铈离子从水溶液中萃取出来,过程表示为:
Ce2(SO4)3(水层)+ 6HT(有机层)![]() 2CeT3 (有机层)+3H2SO4(水层)
2CeT3 (有机层)+3H2SO4(水层)
分液得到CeT3(有机层),再加入H2SO4 获得较纯的含Ce3+的水溶液。可选择硫酸作反萃取剂的原因是___(从平衡移动角度回答)。
【答案】Fe3++3H2O![]() Fe(OH)3(胶体)+3H+ Na2SiO3 2CeO2 + H2O2+ 6H+=2Ce3++O2↑+4 H2O 4Ce(OH)3+O2+2H2O=4Ce(OH)4 77.12g 加入硫酸,可使平衡向左进行,使Ce3+进入水层(或答加入硫酸,平衡左移)
Fe(OH)3(胶体)+3H+ Na2SiO3 2CeO2 + H2O2+ 6H+=2Ce3++O2↑+4 H2O 4Ce(OH)3+O2+2H2O=4Ce(OH)4 77.12g 加入硫酸,可使平衡向左进行,使Ce3+进入水层(或答加入硫酸,平衡左移)
【解析】
废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等)加入氢氧化钠溶液,SiO2能和NaOH反应生成Na2SiO3,滤液A中含有Na2SiO3,滤渣A中含有Fe2O3、CeO2、FeO,向滤渣中加入稀硫酸,Fe2O3和FeO溶于稀硫酸,而CeO2不溶于稀硫酸,滤液B中含有硫酸铁和硫酸亚铁,氧化硫酸亚铁为硫酸铁,再加入硫酸铵溶液,得到硫酸铁铵矾。滤渣B中含有CeO2,加入稀硫酸提供酸性环境,用H2O2还原CeO2得到含Ce3+的溶液,然后加碱得到Ce(OH)3悬浊液,最后用氧气氧化得到Ce(OH)4。
(1)硫酸铁铵矾溶于水电离出Fe3+,Fe3+水解生成Fe(OH)3胶体,能吸附水中的悬浮物,达到净水的目的,其原理用离子方程式表示为Fe3++3H2O![]() Fe(OH)3(胶体)+3H+。
Fe(OH)3(胶体)+3H+。
(2)工业废玻璃粉末含有的成分为SiO2、Fe2O3、CeO2、FeO等,与NaOH溶液反应,SiO2与氢氧化钠反应生成硅酸钠和水,其余均不反应,所以滤液A的主要成分是Na2SiO3。
(3)CeO2不溶于稀硫酸,根据流程图可知,滤渣B为CeO2,CeO2与稀硫酸、H2O2反应生成含Ce3+的溶液,Ce元素得电子,则H2O2中氧元素失电子生成氧气,根据化合价升降总数相等和原子守恒配平,则反应①的离子方程式是2CeO2+H2O2+6H+= 2Ce3++O2↑+4 H2O。
(4)反应②为加热Ce(OH)3的悬浊液得到Ce(OH)4,Ce元素的化合价由+3价失电子生成+4价的Ce,则空气中的氧气得电子生成-2价OH-,根据化合价升降总数相等和原子守恒配平,化学反应方程式为4Ce(OH)3+O2+2H2O = 4Ce(OH)4。
(5)13.2g (NH4) 2SO4(式量132)的物质的量为0.1mol,根据氮守恒,理论上生成的硫酸铁铵矾晶体[Fe2(SO4) 3·(NH4) 2SO4·24H2O,式量964]的物质的量也是0.1mol,其产率为80%,所以实际生成的硫酸铁铵矾晶体的物质的量为0.08mol,为0.08mol×964g/mol=77.12g。
(6)根据Ce2(SO4)3(水层)+ 6HT(有机层)![]() 2CeT3 (有机层)+3H2SO4(水层),加入硫酸,可使平衡向左进行,使Ce3+进入水层。
2CeT3 (有机层)+3H2SO4(水层),加入硫酸,可使平衡向左进行,使Ce3+进入水层。

【题目】海水中含有丰富的资源,其中包括钠离子、氯离子、镁离子等。
(1)氯元素位于元素周期表第________列,写出氯原子的最外层电子排布式________________, 最外层电子所占据的轨道数为________ 个,氯原子核外共有________种能量不同的电子。
(2)列举能说明Mg的金属性比Na弱的一个实验事实__________________。
(3)相同压强下,部分元素氟化物的熔点见下表:
氟化物 | NaF | MgF2 | SiF4 |
熔点/℃ | 1266 | 1534 | 183 |
试解释上表中熔点SiF4远低于NaF的原因_________________________
(4)氨水是实验室最常用的弱碱,向滴有少量酚酞试液的稀氨水,加入少量的NH4AC晶体,若观察到________________则可证明一水合氨是弱电解质。请再提出一个能证明一水合氨是弱电解质的实验方案 ______________________________________
(5)向盐酸中滴加氨水至过量,该过程所发生反应的离子方程式为___________________
在滴加的整个过程中离子浓度大小关系可能正确的是(______)
a.c(C1-)=c(NH4+)>c(H+)=c(OH-) b.c(C1-)>c(NH4+)= c(OH-) >c(H+)
c.c(NH4+)>c(OH-)>c(C1-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(C1-)