题目内容
A、B、C、D四种可溶性离子化合物,其组成中的阴阳离子各不相同.它们在溶液中电离的阴阳离子分别为:Cl-、SO42-、NO3-、OH-、Ag+、Na+、Mg2+、Cu2+.当四种物质相互反应时,有如下现象:①A+B 产生白色沉淀 ②B+D 产生白色沉淀 ③C+D 产生蓝色沉淀
(1)A、B、C、D的化学式分别为:A
(2)写出发生反应的化学方程式:A+B
(1)A、B、C、D的化学式分别为:A
AgNO3
AgNO3
BMgCl2
MgCl2
CCuSO4
CuSO4
DNaOH
NaOH
(2)写出发生反应的化学方程式:A+B
AgNO3+NaCl=AgCl↓+NaNO3
AgNO3+NaCl=AgCl↓+NaNO3
B+DMgCl2+2NaOH=Mg(OH)2↓+2NaCl
MgCl2+2NaOH=Mg(OH)2↓+2NaCl
C+DCuSO4+2NaOH=Cu(OH)2↓+Na2SO4
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
.分析:(1)用表格法进行分析,将溶液两两混合的现象结果记入右表,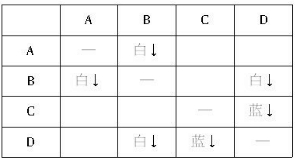
发现B与其他物质反应产生两种白色沉淀(肯定是不同的物质),而题设各离子中能组合为白色沉淀的物质有AgCl、Mg(OH)2;又D与其他物质反应产生一种白色沉淀、一种蓝色沉淀,题设各离子中能组合为蓝色沉淀的物质只有Cu(OH)2,这样可以确定D中含OH-,从而确定D为NaOH;再由“B+D→白色沉淀”确定B为MgCl2;由A、B反应情况确定A为AgNO3;由C、D反应情况确定C为CuSO4.故四种物质分别为AgNO3、MgCl2、CuSO4、NaOH;
(2)根据物质的性质来书写复分解反应的化学方程式.

发现B与其他物质反应产生两种白色沉淀(肯定是不同的物质),而题设各离子中能组合为白色沉淀的物质有AgCl、Mg(OH)2;又D与其他物质反应产生一种白色沉淀、一种蓝色沉淀,题设各离子中能组合为蓝色沉淀的物质只有Cu(OH)2,这样可以确定D中含OH-,从而确定D为NaOH;再由“B+D→白色沉淀”确定B为MgCl2;由A、B反应情况确定A为AgNO3;由C、D反应情况确定C为CuSO4.故四种物质分别为AgNO3、MgCl2、CuSO4、NaOH;
(2)根据物质的性质来书写复分解反应的化学方程式.
解答:解:(1)用表格法进行分析,将溶液两两混合的现象结果记入右表,
发现B与其他物质反应产生两种白色沉淀(肯定是不同的物质),而题设各离子中能组合为白色沉淀的物质有AgCl、Mg(OH)2;又D与其他物质反应产生一种白色沉淀、一种蓝色沉淀,题设各离子中能组合为蓝色沉淀的物质只有Cu(OH)2,这样可以确定D中含OH-,从而确定D为NaOH;再由“B+D→白色沉淀”确定B为MgCl2;由A、B反应情况确定A为AgNO3;由C、D反应情况确定C为CuSO4,故四种物质分别为AgNO3、MgCl2、CuSO4、NaOH,
故答案为:AgNO3;MgCl2;CuSO4;NaOH;
(2)AgNO3、MgCl反应的方程式为AgNO3+NaCl=AgCl↓+NaNO3;
MgCl2、NaOH反应的方程式为MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
CuSO4、NaOH反应的方程式为CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,
故答案为:AgNO3+NaCl=AgCl↓+NaNO3;MgCl2+2NaOH=Mg(OH)2↓+2NaCl;CuSO4+2NaOH=Cu(OH)2↓+Na2SO4.

发现B与其他物质反应产生两种白色沉淀(肯定是不同的物质),而题设各离子中能组合为白色沉淀的物质有AgCl、Mg(OH)2;又D与其他物质反应产生一种白色沉淀、一种蓝色沉淀,题设各离子中能组合为蓝色沉淀的物质只有Cu(OH)2,这样可以确定D中含OH-,从而确定D为NaOH;再由“B+D→白色沉淀”确定B为MgCl2;由A、B反应情况确定A为AgNO3;由C、D反应情况确定C为CuSO4,故四种物质分别为AgNO3、MgCl2、CuSO4、NaOH,
故答案为:AgNO3;MgCl2;CuSO4;NaOH;
(2)AgNO3、MgCl反应的方程式为AgNO3+NaCl=AgCl↓+NaNO3;
MgCl2、NaOH反应的方程式为MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
CuSO4、NaOH反应的方程式为CuSO4+2NaOH=Cu(OH)2↓+Na2SO4,
故答案为:AgNO3+NaCl=AgCl↓+NaNO3;MgCl2+2NaOH=Mg(OH)2↓+2NaCl;CuSO4+2NaOH=Cu(OH)2↓+Na2SO4.
点评:本题考查学生常见离子的检验方面的知识,注意离子的特征离子反应是解体的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 两两组合而成.为了确定这四种化合物的成分,某同学进行了如下实验操作:
两两组合而成.为了确定这四种化合物的成分,某同学进行了如下实验操作:
 两两组合而成.为了确定这四种化合物的成分,某同学进行了如下实验操作:
两两组合而成.为了确定这四种化合物的成分,某同学进行了如下实验操作: