题目内容
下列离子反应方程式书写正确的是( )
| A、用石灰石(CaCO3)与盐酸反应制CO2:CO32-+2H+=H2O+CO2↑ |
| B、用FeCl3溶液溶解单质Fe:Fe3++Fe=2Fe2+ |
| C、用氢氧化钠溶液吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O |
| D、AlCl3溶液与氨水(过量)混合:Al3++4NH3﹒H2O=AlO2-+4NH4++2H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A、碳酸钙不溶于水,离子方程式中应写成化学式;
B、得失电子不守恒;
C、氯气自身的氧化还原反应;
D、氢氧化铝不溶于弱碱.
B、得失电子不守恒;
C、氯气自身的氧化还原反应;
D、氢氧化铝不溶于弱碱.
解答:
解:A、电荷不守恒,正确的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O,故A错误;
B、得失电子不守恒,正确的离子方程式为2Fe3++Fe=3Fe2+,故B错误;
C、氯气自身的氧化还原反应,离子方程式中应写成化学式,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故C正确;
D、氢氧化铝不溶于弱碱,正确的离子方程式为:Al3++3NH3﹒H2O=Al(OH)3↓+3NH4+,故D错误;
故选C.
B、得失电子不守恒,正确的离子方程式为2Fe3++Fe=3Fe2+,故B错误;
C、氯气自身的氧化还原反应,离子方程式中应写成化学式,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故C正确;
D、氢氧化铝不溶于弱碱,正确的离子方程式为:Al3++3NH3﹒H2O=Al(OH)3↓+3NH4+,故D错误;
故选C.
点评:本题考查离子方程式的书写,题目难度不大,注意从化学式、离子符号、电荷守恒以及是否符合反应实际的角度分析.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某烃只能生成一种一氯代物,该烃的分子式不可能是( )
| A、CH4 |
| B、C2H6 |
| C、C4H10 |
| D、C5H12 |
下列有关丙烷的叙述中正确的是( )
| A、分子中碳原子在一条直线上 |
| B、光照下能够发生加成反应 |
| C、丙烷比丁烷更易液化 |
| D、乙烯和丙烷可用溴水鉴别 |
有六种物质:①甲烷、②苯、③聚乙烯、④苯乙烯、⑤2-丁炔、⑥邻二甲苯,既能使酸性高锰酸钾溶液褪色,又能使溴水因反应而褪色的是( )
| A、①②③ | B、③④⑤ |
| C、④⑤ | D、③④⑥ |
 2008年诺贝尔化学奖授予了钱永键等三位科学家,以表彰他们在发现和研究绿色荧光蛋白质(简称GFP)方面做出的卓越贡献.生色团是GFP发出荧光的物质基础,也是GFP结构中的一个重要组成部分,多管水母中GFP生色团的化学结构如图,下列说法正确的是( )
2008年诺贝尔化学奖授予了钱永键等三位科学家,以表彰他们在发现和研究绿色荧光蛋白质(简称GFP)方面做出的卓越贡献.生色团是GFP发出荧光的物质基础,也是GFP结构中的一个重要组成部分,多管水母中GFP生色团的化学结构如图,下列说法正确的是( )| A、该生色团不与NaHCO3反应 |
| B、该生色团分子式C30H37N8O9 |
| C、该生色团可以水解得到5种有机物 |
| D、该生色团中的肽键数为3 |
下列各组离子能在呈酸性的无色溶液中大量共存的是( )
| A、Ba2+、Na+、NO3-、Cl- |
| B、Ca2+、Na+、Fe3+、SO32- |
| C、K+、OH-、HCO3-、NO3- |
| D、Mg2+、Cl-、Al3+、SO42- |
下列各组变化中,化学反应的能量变化(△H或Q)前者小于后者的是( )
| A、CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1;CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2 | ||
B、H2(g)+
| ||
| C、t℃时,在一定条件下,将1 mol SO2和1 mol O2分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q1、Q2 | ||
| D、CaCO3(s)═CaO(s)+CO2 (g)△H1;CaO(s)+H2O(l)═Ca(OH)2(s)△H2 |
 在一定条件下,密闭容器中进行的反应:H2+I2?2HI对于下列示意图所表示的涵义解释正确的是( )
在一定条件下,密闭容器中进行的反应:H2+I2?2HI对于下列示意图所表示的涵义解释正确的是( )| A、反应开始时,容器中投入了H2、I2、HI三种气体 |
| B、0到t1时刻,反应向逆反应方向进行 |
| C、t1时刻后,正、逆反应的速率均为零 |
| D、t1时刻后,H2、I2、HI三种气体的浓度达到相等 |
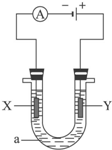 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请完成以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请完成以下问题: