题目内容
“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用.如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示(部分条件及物质未标出).
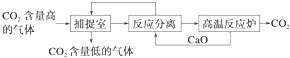
下列有关该方法的叙述中正确的是( )
①能耗小是该方法的一大优点
②整个过程中,有二种物质可以循环利用
③“反应分离”环节中,分离物质的基本操作是过滤、蒸发、结晶
④该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品.

下列有关该方法的叙述中正确的是( )
①能耗小是该方法的一大优点
②整个过程中,有二种物质可以循环利用
③“反应分离”环节中,分离物质的基本操作是过滤、蒸发、结晶
④该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品.
| A、①③ | B、②④ | C、③④ | D、①④ |
考点:碳族元素简介
专题:碳族元素
分析:用烧碱来吸二氧化碳发生在捕捉室,生成碳酸钠与氧化钙作用发生在分离室,同时又生成烧碱,碳酸钙高温分解生成氧化钙和二氧化碳发生在高温炉,有两种物质CaO、NaOH循环,“反应分离”环节中,应该是先过滤,滤液不需要浓缩结晶,直接循环使用.
解答:
解:①.碳酸钙的分解在高温条件下进行,消耗能量大,故①错误;
②.基本过程中有两个反应:①二氧化碳与氢氧化钠反应,②碳酸钙的高温分解,循环利用的应该有CaO和NaOH 两种物质,故②正确;
③.“反应分离”过程中分离物质的操作应该是过滤,目的是通过过滤得到碳酸钙沉淀,故③错误;
④.甲醇工业上可用CO2制备,故④正确.
故选B.
②.基本过程中有两个反应:①二氧化碳与氢氧化钠反应,②碳酸钙的高温分解,循环利用的应该有CaO和NaOH 两种物质,故②正确;
③.“反应分离”过程中分离物质的操作应该是过滤,目的是通过过滤得到碳酸钙沉淀,故③错误;
④.甲醇工业上可用CO2制备,故④正确.
故选B.
点评:本题考查物质的分离、提纯的实验方案的设计,题目难度中等,注意把握题给信息,为解答该题的关键.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
氢氟酸为弱酸.250C时将0.1mol?L-1的HF加水不断稀释,下列表示的量保持不变的是( )
①n(H+); ②c(H+)?c(OH-);③c(OH-)+c(F-);④
⑤
.
①n(H+); ②c(H+)?c(OH-);③c(OH-)+c(F-);④
| c(H+) |
| c(HF) |
| c(H+).c(F-) |
| c(HF) |
| A、①③④ | B、②③④ |
| C、③④⑤ | D、②⑤ |
下列关于金属晶体的描述不正确的是( )
| A、金属具有良好的延展性,是因为晶体中的原子层可以相对滑动而不破坏金属键 |
| B、可用“电子气理论”解释金属具有良好的导电性 |
| C、常温下,金属单质都以金属晶体的形式存在 |
| D、温度越高,金属的导电性越弱 |
下面关于金属钠的描述正确的是( )
| A、Na2O和Na2O2中阴阳离子个数比都为1:2 |
| B、钠离子和钠原子都具有较强的还原性 |
| C、钠能把钛锆等金属从它们的盐溶液中还原出来 |
| D、钠和钾的合金于室温下呈固态,可做原子反应堆的导热剂 |
下列有关硫及其化合物的叙述中正确的是( )
| A、浓H2SO4可用于干燥Cl2,但不能干燥SO2 |
| B、SO2具有漂白性,所以它能使碘的淀粉溶液由蓝色变为无色 |
| C、向Na2S2O3溶液中加入盐酸产生淡黄色沉淀 |
| D、SO2和Cl2分别与双氧水反应均产生O2 |
红热的木炭与浓HNO3反应产生的气体经如下处理:
气体产物
气体Ⅰx mL
气体Ⅱy mL(在无氧环境下操作)假设气体体积均在相同状况下测定,不考虑气体的溶解,则x和y的关系是( )
气体产物
| 浓H2SO4干燥 |
| ①足量饱和NaHCO3溶液 |
| ②浓H2SO4干燥 |
A、x=
| ||
B、y=
| ||
| C、x=y | ||
D、y=
|
生活中每时每刻都发生着各种化学反应,下列反应不一定属于放热反应的是( )
| A、硫酸和氢氧化钡溶液的反应 |
| B、燃烧反应 |
| C、复分解反应 |
| D、中和反应 |

