题目内容
【题目】活性炭吸附法是工业提碘的主要方法之一,其流程如图:
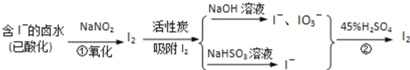
完成下列填空:
(1)酸性条件下,NaNO2溶液只能将I﹣氧化为I2,同时生成NO.写出反应①的离子方程式______.
(2)氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中的I﹣选择了价格并不便宜的亚硝酸钠,可能的原因是______.
(3)反应②发生时,溶液底部有紫黑色固体生成,有时溶液上方产生紫色气体,产生这种现象的原因是______.
(4)流程中,碘元素经过了I﹣→I2→I﹣、IO3﹣→I2的变化过程,这样反复操作的目的是______.
(5)流程中所用的NaHSO3溶液显弱酸性,源于NaHSO3存在以下两种程度不同的平衡体系:
①水解______和电离______(用离子方程式表示)
②如向0.1mol/L的NaHSO3溶液中分别加入以下物质,回答问题:
加入少量Ba(OH)2固体,水解平衡向______移动;加入少量NaClO固体,溶液的pH______(选填:增大、减小、不变).
【答案】2NO2﹣+4H++2I﹣═2NO+I2+2H2O 氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质 碘在水中的溶解度不大,且易升华 富集碘元素 HSO3﹣+H2OH2SO3+OH﹣ HSO3﹣SO32﹣+H+ 逆反应方向 减小
【解析】
(1)亚硝酸钠具有氧化性,碘离子具有还原性,酸性条件下,二者发生氧化还原反应生成一氧化氮和碘和水,离子反应方程式为:![]() ;
;
(2)氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质,故工业上氧化卤水中I选择了价格并不便宜的亚硝酸钠,故答案为:氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质;
(3)反应②发生时,溶液底部有紫黑色的固体生成,有时溶液上方产生紫色的气体,解释产生这种现象的原因碘在水中的溶解度不大,且易升华,所以,反应②需要在水浴加热条件下进行,故答案为:碘在水中的溶解度不大,且易升华;
(4)流程中,卤水中碘元素浓度不高,碘元素经过了I2→I、![]() →I2的变化过程,这样反复的目的是富集碘元素,故答案为:富集碘元素;
→I2的变化过程,这样反复的目的是富集碘元素,故答案为:富集碘元素;
(5)①NaHSO3溶液显弱酸性,是因为该溶液中存在以下的平衡:①水![]() 和②电离:
和②电离:![]() ,电离程度大于水解程度;
,电离程度大于水解程度;
②加入Ba(OH)2,OH浓度增大,平衡逆向移动,加入少量NaClO固体,发生氧化还原反应生成硫酸和氯化钠,溶液pH减小,故答案为:逆反应方向;减小。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案【题目】溶液X中含有下表离子中的某5种,且其浓度均为0.1 mol·L1(不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析,反应前后阴离子种类没有变化。下列叙述不正确的是( )
阳离子 | 阴离子 |
Na+、Fe3+、Fe2+、Mg2+ | NO3-、HCO3-、CO32-、SO42-、Cl- |
A.X溶液中一定含Fe3+、Fe2+
B.X溶液中不可能含有HCO3-或CO32-
C.生成无色气体的离子方程式为:3Fe2+ +NO3-+4H+===3Fe3++NO ↑ +2H2O
D.根据电荷守恒,原溶液中一定含Mg2+
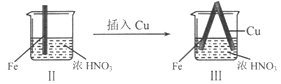
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化