题目内容
向4.0 L容器中充入0.70 mol SO2和0.40 mol O2 , 4 s末测得剩余SO2 0.30 mol,则v(O2)为( )
A.0.10 mol·L-1·s-1 B.0.025 mol·L-1·s-1
C.0.50 mol·L-1·s-1 D.0.0125 mol·L-1·s-1
D
【解析】反应速率通常用单位时间内浓度的变化量来表示,4 s末测得剩余SO2 0.30 mol,则消耗SO2是0.4mol,因此必然同时消耗氧气0.2mol,所以氧气的反应速率为
 ,因此答案选D。
,因此答案选D。

(12分)150 ℃时,向如图所示的容器(密封的隔板可自由滑动,整个过程中保持隔板上部压强不变)中加入4 L N2和H2的混合气体,在催化剂作用下充分反应(催化剂体积忽略不计),反应后恢复到原温度。平衡后容器体积变为3.4 L,容器内气体对相同条件的氢气的相对密度为5。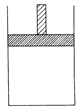
(1)反应前混合气体中V(N2)?:V(H2)=____________;反应达平衡后V(NH3)=____________L;该反应中N2转化率为____________。
(2)向平衡后的容器中充入0.2 mol的NH3,一段时间后反应再次达到平衡,恢复到150 ℃时测得此过程中从外界吸收了6.44 kJ的热量。
①充入NH3时,混合气体的密度将____________,在达到平衡的过程中,混合气体的密度将____________(填“增大”、“减小”或“不变”)。反应重新达平衡的混合气体对氢气的相对密度将____________5(填“>”、“<”或“=”)。
②下列哪些实验现象或数据能说明反应重新到达了平衡____________。
| A.容器不再与外界发生热交换 |
| B.混合气体的平均相对分子质量保持不变 |
| C.当V(N2)?:V(H2):?V(NH3)=1:?3?:2时 |
| D.当容器的体积不再发生变化时 |
向4.0 L容器中充入0.70 mol SO2和0.40 mol O2 , 4 s末测得剩余SO2 0.30 mol,则v(O2)为( )
| A.0.10 mol·L-1·s-1 | B.0.025 mol·L-1·s-1 |
| C.0.50 mol·L-1·s-1 | D.0.0125 mol·L-1·s-1 |