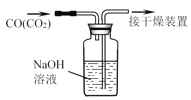
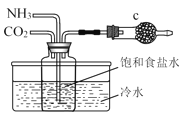
题目内容
【题目】下表为元素周期表的一部分,请参照元素①~⑦在表中的位置,用化学用语回答下列问题:

(1)①在周期表中的位置是__,②、⑤原子半径的大小关系为__(填元素符号)。
(2)①、⑤、⑦的最高价含氧酸的酸性由强到弱的顺序是__(填化学式)。
(3)③和⑥的气态氢化物稳定性强弱关系__(填化学式)。
(4)④和⑦两种单质形成的化合物含有的化学键__(填“共价键”或“离子键”),③和⑥两种单质反应的化学方程式__。
(5)②的最简单氢化物与其最高价氧化物对应水化物反应的离子方程式为__。
【答案】第二周期ⅣA族 r(Si)>r(N) HClO4>H2CO3>H2SiO3 H2O>H2S 离子键 S+O2![]() SO2 NH3+H+=NH
SO2 NH3+H+=NH![]()
【解析】
按元素在周期表中的位置可知,①为C、②为N、③为O、④为Na、⑤为Si、⑥为S、⑦为Cl,结合元素周期律回答;
(1)①是C,在周期表中的位置是第二周期ⅣA族,根据同主族原子电子层数越多其原子半径越大、同周期从左到右原子半径递减,则原子半径的大小关系r(Si)> r(C)>r(N),则r(Si)>r(N);
故答案为:第二周期ⅣA族;r(Si)>r(N);
(2)元素非金属性越强,其最高价氧化物的水化物酸性越强,①、⑤、⑦非金属性强弱顺序是Cl>C>Si,则其最高价含氧酸的酸性由强到弱的顺序是HClO4>H2CO3>H2SiO3;
答案为:HClO4>H2CO3>H2SiO3;
(3) 非金属性越强,气态氢化物稳定性就越强;根据同主族元素从上到下非金属性逐渐减弱可知,③和⑥的非金属性为O>S,则气态氢化物稳定性强弱关系为H2O>H2S;
答案为:H2O>H2S;
(4)④和⑦两种单质形成的化合物为氯化钠,是典型的离子化合物,含有的化学键为离子键,③的单质是氧气,⑥的单质是硫,反应的化学方程式为:S+O2![]() SO2;
SO2;
答案为:离子键;S+O2![]() SO2;
SO2;
(5)②的最简单氢化物为氨气,其最高价氧化物对应水化物为硝酸,两者反应生成硝酸铵,则反应的离子方程式为NH3+H+=NH![]() ;
;
答案为:NH3+H+=NH![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】用如图所示装置检验对应气体时,不能达到目的是( )
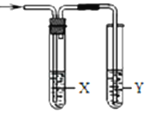
除杂装置 检验装置
生成的气体 | 试剂 | 试剂 | |
| 电石与水反应制取的乙炔 |
|
|
| 木炭与浓 | 饱和 | 澄清石灰水 |
|
| 水 |
|
|
|
|
|
A. AB. BC. CD. D