题目内容
【题目】化学热力学是物理化学的重要分支。请根据所学知识回答下列问题:
(1)最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
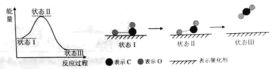
①CO和O生成CO2是______反应(填吸热或放热)
②状态Ⅲ生成的分子含有____(填极性键或非极性键),该分子的电子式____
(2)已知一定条件下合成氨反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.0 kJ·mol-1,相同条件下将1 mol N2和3 mol H2放在一密闭容器中充分反应,测得反应放出的热量(假定热量无损失)________92.0 kJ。(填=、>或<)
2NH3(g) ΔH=-92.0 kJ·mol-1,相同条件下将1 mol N2和3 mol H2放在一密闭容器中充分反应,测得反应放出的热量(假定热量无损失)________92.0 kJ。(填=、>或<)
(3)同温同压下,H2(g)+Cl2(g)===2HCl(g),在光照和点燃条件下的ΔH(化学计量数相同)分别为ΔH1、ΔH2,则ΔH1________ΔH2。(填=、>或<)
(4)用O2将HCl转化为Cl2,可提高效益,减少污染,传统上该转化通过如图所示的催化剂循环实现,

反应①为2HCl(g) + CuO(s) =H2O(g)+CuCl2(g) △H1
反应②生成1molCl2(g)的反应热为△H2
则总反应的热化学方程式为_______, (反应热用△H1和△H2表示)。
(5)已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648kJ/mol
C(s)+O2(g)=CO2(g) ΔH=-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的ΔH=________
(6)乙苯催化脱氢制苯乙烯反应:![]() (g)
(g)![]()
![]() (g)+H2(g)
(g)+H2(g)
已知:
化学键 | C-H | C-C | C=C | H-H |
键能/kJ·mol-1 | 412 | 348 | 612 | 436 |
计算上述反应的△H=________ 。
【答案】放热 极性键 ![]() < = 2HCl(g)+
< = 2HCl(g)+![]() O2(g)=Cl2(g)+H2O(g) ΔH=ΔH1+ΔH2 -260 kJ/mol +124 kJ/mol
O2(g)=Cl2(g)+H2O(g) ΔH=ΔH1+ΔH2 -260 kJ/mol +124 kJ/mol
【解析】
(1)根据反应物和生成物的能量高低判断;
(2)根据可逆反应特点考虑;
(3)焓变与反应条件无关,只与反应的始态和终态有关;
(4)根据盖斯定律计算反应热并写出热化学方程式;
(5)根据盖斯定律计算反应热;
(6)反应热=反应物键能总和-生成物键能总和
(1)①由图可知反应物总能量大于生成物总能量,为放热反应,答案为:放热;
②根据图示中原子的变化可知反应最后生成的是CO2,在CO2中C原子和O原子之间通过共用电子对形成极性共价键,C原子与每个O原子形成两个共用电子对,所有原子都达到8电子稳定结构,CO2电子式为:![]() ,答案为:极性键;
,答案为:极性键;![]() ;
;
(2)合成氨反应是可逆反应,相同条件下将相同条件下1 mol N2和3 mol H2不能完全反应生成2 molNH3,所以放热小于92.0 kJ,答案为:< ;
(3)反应焓变与起始物质能量和终了物质能量差有关,与反应条件无关,同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH相同,答案为:=;
(4)反应①为:2HCl(g) + CuO(s) =H2O(g)+CuCl2(s) △H1,反应②生成1molCl2(g)的反应热为△H2,由图示可知反应②为:CuCl2(s)+![]() O2(g)= CuO(s) +Cl2(g) △H2,根据盖斯定律①+②可得总反应的热化学方程式:2HCl(g)+
O2(g)= CuO(s) +Cl2(g) △H2,根据盖斯定律①+②可得总反应的热化学方程式:2HCl(g)+![]() O2(g)=Cl2(g)+H2O(g) ΔH=ΔH1+ΔH2;
O2(g)=Cl2(g)+H2O(g) ΔH=ΔH1+ΔH2;
(5)已知:①4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1648kJ/mol
②C(s)+O2(g)=CO2(g) ΔH=-393kJ/mol
③2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1480kJ/mol
根据盖斯定律,①-③2+②4可得热化学方程式:4FeCO3(s) +O2(g)=2Fe2O3(s) +4CO2(g) ,所以FeCO3在空气中加热反应生成Fe2O3的ΔH=-1648kJ/mol-2(-1480kJ/mol)+4(-393kJ/mol)=-260 kJ/mol,答案为:-260 kJ/mol;
(6)反应热=反应物键能总和-生成物键能总和,由反应中有机物的结构可知,应是—CH2CH3中键能与—CH=CH2、H2总键能之差,所以ΔH=(5412+348-3412-612-436) kJ/mol=+124 kJ/mol。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】截止2020年4月5日,全球新型冠状病毒肺炎确诊超过120万例。以下对预防新冠病毒的认识,不符合科学道理的是( )
A | B | C | D |
|
|
|
|
84消毒液使用时不能和洁厕灵混用 | 医用酒精消毒效果浓度95%>75% | 口罩关键一层聚丙烯熔喷布属于有机高分子材料 | 温度计中水银属于金属单质 |
A.AB.BC.CD.D
【题目】在1×105Pa和298K时,将1mol气态AB分子分离成气态A原子和B原子所需要的能量称为键能(kJ/mol)。下面是一些共价键的键能:(已知氨分子中有三个等价的氮氢共价键)
共价键 | H-H键 | N三N键 | N-H键 |
键能(kJ/mo1) | 436 | 945 | 391 |
工业合成氨的化学方程式:N2+3H2![]() 2NH3
2NH3
(1)断开1molN2中的化学键需_______(填“吸收”或“放出”)_____kJ能量;
(2)形成2molNH3中的化学键需_______(填“吸收”或“放出”)__kJ能量;
(3)在298K时,取1molN2和3molH2放入一密闭容器中,在催化剂存在下进行反应。理论上放出或吸收的热量为Q1,则Q1为_____kJ。根据上表中的数据判断工业合成氨的反应是_______(填“吸热”或“放热”)反应。