题目内容
【题目】工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。
(1)工业上可用氨催化吸收法处理NOx,反应原理如下:4xNH3+6 NOx![]() (2x + 3)N2 + 6xH2O某化学兴趣小组模拟该处理过程的实验装置如下:
(2x + 3)N2 + 6xH2O某化学兴趣小组模拟该处理过程的实验装置如下:

①装置A中发生反应的化学方程式为_______。
②装置D中碱石灰的作用是______。
(2)工业上也常用Na2CO3溶液吸收法处理NOx。
已知:NO不能与Na2CO3溶液反应。
NO + NO2 + Na2CO3 = 2NaNO2 + CO2 (I)
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2 (II)
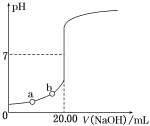
①将1molNOx通入Na2CO3溶液中,被完全吸收时,溶液中生成的NO3ˉ、NO2ˉ两种离子的物质的量随x变化关系如下图所示,则图中线段a表示______离子随x值变化的关系;

②为了检测吸收液中NaNO2含量,某兴趣小组取100ml该吸收液,用0.005mol·L–1的高锰酸钾(酸性)溶液滴定,消耗高锰酸钾溶液的体积为16.00mL。(已知:2MnO4–+5NO2–+6H+=2Mn2++5NO3–+3H2O)。则吸收液中NaNO2的物质的量浓度为多少?__________
【答案】2NH4Cl +Ca(OH)2![]() CaCl2+ 2NH3↑ + 2H2O 除去气体中含有的水蒸气 NO2– 0.002mol·L–1
CaCl2+ 2NH3↑ + 2H2O 除去气体中含有的水蒸气 NO2– 0.002mol·L–1
【解析】
(1)①装置A中,NH4Cl 与Ca(OH)2发生复分解反应,生成CaCl2 、NH3、H2O。
②装置D中碱石灰的作用是干燥氨气。
(2)①当x=0.5时,气体的平均组成为NO1.5,此时NO、NO2按体积比为1:1混合,只发生反应(I),随着x的不断增大,NO2的含量不断增多,此时不仅发生反应(I),还发生反应(II)。只有发生反应(II)后,溶液中才生成NO3ˉ,由此可得出图中线段a表示的离子;
②设NaNO2的物质的量为x
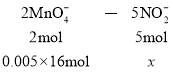
![]() =0.0002mol,再求c(NaNO2)。
=0.0002mol,再求c(NaNO2)。
(1)①装置A中,NH4Cl 与Ca(OH)2发生复分解反应,生成CaCl2 、NH3、H2O,反应的化学方程式为2NH4Cl +Ca(OH)2![]() CaCl2 + 2NH3↑ + 2H2O。答案为:2NH4Cl +Ca(OH)2
CaCl2 + 2NH3↑ + 2H2O。答案为:2NH4Cl +Ca(OH)2![]() CaCl2 + 2NH3↑ + 2H2O;
CaCl2 + 2NH3↑ + 2H2O;
②装置D中碱石灰的作用是干燥氨气(或除去气体中含有的水蒸气)。答案为:除去气体中含有的水蒸气;
(2)①当x=0.5时,气体的平均组成为NO1.5,此时NO、NO2按体积比为1:1混合,只发生反应(I),随着x的不断增大,NO2的含量不断增多,此时不仅发生反应(I),还发生反应(II)。只有发生反应(II)后,溶液中才生成NO3ˉ,由此可得出图中线段a表示的离子为NO2–;答案为:NO2–;
②设NaNO2的物质的量为x
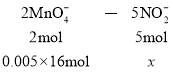
![]() =0.0002mol,再求c(NaNO2)=
=0.0002mol,再求c(NaNO2)=![]() =0.002mol·L–1。答案为:0.002mol·L–1。
=0.002mol·L–1。答案为:0.002mol·L–1。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案