题目内容
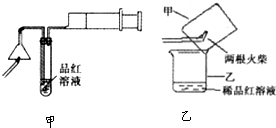
某研究性学习小组为研究铁粉与浓硫酸反应所生成气体的成份并测定各气体的含量,进行了如下实验:
[实验推测]足量的铁粉与浓硫酸反应能生成SO2和H2两种气体.
(1)该小组作出此推测的理由是:________.
[实验准备]
a.供选择的药品:铁粉、浓硫酸、氧化铜粉末、0.2 mol/L的H2C2O4标准溶液、0.1 mol/L的酸性KMnO4标准溶液、酸碱指示剂.
b.实验装置设计及组装(加热及夹持装置均已略去)

[实验过程及数据处理]
(2)B中发生反应的离子方程式为:________.
(3)实验前先通入一段时间的N2,其目的是________.
(4)B、C、D中所盛试剂均足量,则证实生成的气体中同时存在SO2和H2的现象是________.
(5)A中反应结束后,继续通N2使A中生成的气体全部赶出,待B、D中反应完全后,先后三次取用B中反应后的溶液于锥形瓶中,每次取用25 mL,用H2C2O4标准溶液进行滴定.
①H2C2O4标准溶液与酸性KMnO4溶液反应的离子方程式如下,请将该方程式完成并配平.
( )H2C2O4+( )MnO4-+( )H+=( )Mn2++( )H2O+( )( )
②滴定达到终点时的现象是________.
③重复滴定两次,平均每次耗用H2C2O4标准溶液15.63 mL,则铁与浓硫酸反应产生的SO2气体的物质的量为________;经称量,实验前后装置D的质量减少0.8 g,则产生的气体中SO2的体积分数为________.
解析:
|
(1)在加热的条件下浓硫酸与Fe反应生成SO2,随着反应的进行,硫酸浓度变稀,与Fe反应生成H2 (2)5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+ (3)排除装置中的空气,防止H2与空气混合受热发生爆炸. (4)B瓶中溶液紫红色变浅说明生成了SO2,D中黑色粉末变红说明生成了H2.(答对一种得1分) (5)①5、2、6、2、8、10CO2 ②滴入最后一滴H2C2O4溶液时KMnO4溶液的紫红色褪去且半分钟之内不恢复. ③0.025 mol 33.3% |

| 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | 35℃以上分解 | |||
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
| A、第一、二步反应的基本类型为化合反应、分解反应 |
| B、第一、二步反应之间的主要实验操作是过滤、洗涤 |
| C、第一步反应控制温度高于30℃目的是提高反应产率 |
| D、反应液加盐酸处理可使NaCl循环使用并回收NH4Cl |
 有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.
有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.