题目内容
【题目】为验证还原性:SO2>Fe2+>C1-,三组同学分别进行了下图实验,并对溶液1和溶液2中所含离子进行了检验,能证明上述还原性顺序的实验组有
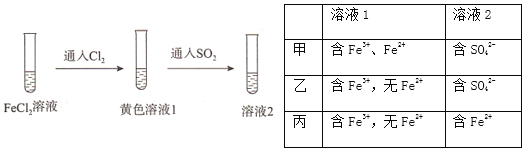
A. 只有甲 B. 甲、乙 C. 甲、丙 D. 甲、乙、丙
【答案】C
【解析】本实验利用“还原剂的还原性大于还原产物”、“强还原性制弱还原性”的原理来验证还原性的强弱顺序。向FeC12溶液中通入C12,得到溶液1,再向溶液1中通入SO2,得到溶液2。
甲、溶液1中含有Fe3+、Fe2+,说明发生反应2Fe2++C12=2Fe3++2Cl-,且C12反应完全,可证明还原性Fe2+>C1-;溶液2中含有SO42-,则说明发生反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,可证明还原性SO2> Fe2+ ,故甲能证明还原性SO2>Fe2+>C1-;乙、溶液1中含有Fe3+,无Fe2+剩余,则还原性Fe2+>C1-,但C12可能过量,再通入SO2,可能发生的反应是C12+SO2+2H2O=2Cl-+SO42-+4H+,不能够比较SO2与Fe2+的还原性强弱,故乙不能验证;丙、溶液1中含有Fe3+,没有Fe2+,通入SO2后溶液中又含有Fe2+,说明SO2将Fe3+还原得到Fe2+,证明SO2> Fe2+还原性,故丙实验结论能证明还原性SO2>Fe2+>C1-。故选C。

 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案【题目】实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,请根据实验回答:
(1)将准确称取的4.3g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒、托盘天平外,还必须用到的仪器有:、 .
(2)取10.00mL待测液,选择下图中(填A或B)来移取.![]()
(3)用0.2000标准盐酸滴定待测烧碱溶液,以酚酞为指示剂.滴定时左手旋转滴定管玻璃活塞,右手不停地摇动锥形瓶,两眼注视 , 直到滴定终点.滴定达到终点的标志是: .
(4)根据下列数据,烧碱的纯度为:(精确到小数点后一位)
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(5)判断下列操作引起的误差(填“偏大”、“偏小”或“无影响”)①滴定前读数正确,滴定终点读数时仰视. .
②未用标准液润洗滴定管. .
③滴定终点时发现滴定管尖嘴处悬挂着一滴溶液. .