题目内容
【题目】氮氧化物(NOx)是一种主要的大气污染物,必须进行处理。
(1)汽车发动机工作时会引发N2和O2反应生成NO,其反应过程中的能量变化如下:
反应 | N2(g)→2N(g) | O2(g)→2O(g) | N(g)+O(g)→NO(g) |
反应热 | ΔH 1 | ΔH 2 | ΔH 3 |
热量值kJ·mol-1 | 945 | 498 | 630 |
①ΔH 1_____0,ΔH 3_____0。(填“>”或“<”)
②N2(g)+O2(g) = 2NO(g) ΔH=______kJ·mol-1。
(2)利用NH3在一定条件下与NO反应生成无污染的气体。其热化学方程式为:4NH3 (g)+6NO(g) =5N2(g)+6H2O(g) ΔH=-1807.98 kJ·mol-1,下列能表示该反应中能量变化的是_______(填字母)。
A. 
B. 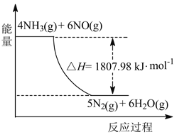
C. 
(3)利用甲烷催化还原氮氧化物。已知:
CH4 (g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
H2O(l) = H2O(g) ΔH=+44 kJ·mol-1
则CH4 (g)+2NO2(g)=N2 (g)+CO2(g)+2H2O(g) ΔH=________,1.6 g CH4还原NO2 生成N2和液态水时放出的热量为______kJ。
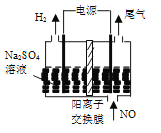
(4)利用电解法处理含氮氧化物的废气。实验室模拟电解法吸收NO,装置如图所示(均为石墨电极),电解过程中NO转化为硝酸的化学方程式为______。
【答案】> < 183 B -867 kJ·mol-1 95.5 2NO+4H2O![]() 2HNO3+3H2
2HNO3+3H2
【解析】
(1)①断裂化学键需要吸收能量,形成化学键需要放出能量;
②盖斯定律计算得到反应的焓变;
(2) 4NH3 (g) +6NO (g) =5N2 (g)+6H2O (g) △H=-1807.98kJ.mol-1,反应为放热反应,反应物能量高于生成物,据此分析判断图象;
(3) 根据盖斯定律计算,由(①+②)×![]() -③×2得反应;
-③×2得反应;
(4)阳极上一氧化氮失电子生成硝酸,阴极上氢离子得到电子生成氢气,结合电荷守恒和原子守恒配平书写电极反应,得到反应的化学方程式。
(1)①N2(g)→2N(g)是断裂化学键吸收能量,△H1 >0,N(g)+O(g)→NO(g)是形成化学键放出能量,△H3 < 0;
②Ⅰ、N2(g)→2N(g) △H1 = +945kJ/mol;
Ⅱ、O2(g)→2O(g) △H2 = 498kJ/mol;
Ⅲ、N(g)+O(g)→NO(g) △H3 = -630kJ/ mol;
盖斯定律计算Ⅰ+Ⅱ +2×Ⅲ得到N2(g)+O2(g) = 2NO(g) △H =+183kJ/mol;
(2) 4NH3 (g)+6NO(g) =5N2(g)+6H2O(g) ΔH=-1807.98 kJ·mol-1,反应为放热反应,反应物能量高于生成物,反应焓变为负值为-1807.98 kJ·mol-1,
答案选B;
(3)①CH4 (g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) ΔH= -574 kJ·mol-1
②CH4(g)+4NO(g) = 2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
③H2O(l) = H2O(g) ΔH=+44 kJ·mol-1
盖斯定律计算(①+②)×![]() -③×2得到CH4与NO2反应生成N2(g)和H2O(g)的热化学方程式:CH4 (g)+2NO2(g)=N2 (g)+CO2(g)+2H2O(l) △H=-955 kJ·mol-1;
-③×2得到CH4与NO2反应生成N2(g)和H2O(g)的热化学方程式:CH4 (g)+2NO2(g)=N2 (g)+CO2(g)+2H2O(l) △H=-955 kJ·mol-1;
1mol CH4还原二氧化氮生成N2和液态水放出热量955kJ,1.6gCH4物质的量![]() = 0.1mol,还原NO2生成N2和液态水时放出的热量为95.5kJ;
= 0.1mol,还原NO2生成N2和液态水时放出的热量为95.5kJ;
(4)电解过程中阳极反应中NO转化为硝酸的电极反应式为: NO- 3e- + 2H2O =NO3- +4H+,阴极电极反应为:2H++2e-=H2↑,电解过程中NO转化为硝酸的化学方程式为: 2NO+4H2O![]() 2HNO3+3H2。
2HNO3+3H2。

【题目】下列生产或实验事实引出的相应结论不正确的是( )
选项 | 事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间变短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
B | 工业制硫酸中,在SO3的吸收阶段,吸收塔里要装填瓷环 | 增大气液接触面积,使SO3的吸收速率增大 |
C | 在容积可变的密闭容器中发生反应:2NH3(g) | 正反应速率加快,逆反应速率减慢 |
D | A、B两支试管中分别加入等体积5%的H2O2,在B试管中加入2~3滴FeCl3溶液,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
A. A B. B C. C D. D