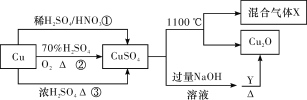
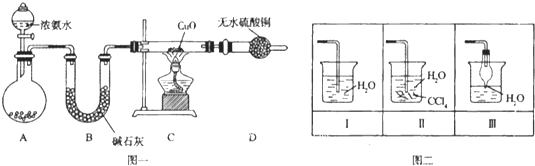
��Ŀ����
����Ŀ����1��FeCl3 ���о�ˮ���ã����ḯʴ�豸����ش��������⣺
��FeCl3��ˮ��ԭ���� ��FeCl3 ��Һ��ʴ�����豸����H�������⣬��һ��Ҫԭ����(�����ӷ���ʽ��ʾ) ��
�����NaClO3 ��������Һ������FeCl2�����ӷ���ʽ��
![]() ClO3��+
ClO3��+ ![]() Fe2��+
Fe2��+ ![]() ==
== ![]() Cl��+
Cl��+ ![]() Fe3��+
Fe3��+![]()
��2����ҵ�ϴӺ�������⣬���������ữ��MnO2����I����д����ص����ӷ���ʽ ��
��3�����й�ϵͼ�У�A��һ�����Σ�D����Է���������C����Է���������16��E��ǿ�ᡣ��X������ǿ�ỹ��ǿ��ʱ����������ת����ϵ����X��ǿ��ʱ��A��B��C��D��E������ͬһԪ�أ���X��ǿ��ʱ��A��B��C��D��E��������һ��Ԫ�ء��ش��������⣺
![]()
�ٵ�X��ǿ��ʱ��д��B����C�Ļ�ѧ����ʽ ��
�ڵ�X��ǿ��ʱ��д��Ũ��E��Һ�������B��Ӧ�Ļ�ѧ����ʽ ��
�۵�X��ǿ��ʱ����������B����IJ������������� ��
���𰸡���1����Fe3++3H2O![]() Fe(OH)3+3H+��2Fe3++ Fe��3Fe2+��
Fe(OH)3+3H+��2Fe3++ Fe��3Fe2+��
��1ClO3-+6Fe2++6H+��1Cl-+ 6Fe3++3H2O
��2��MnO2+4H++2I-��Mn2++I2+2H2O
��3����2H2S+3O2=2SO2+2H2O ��3H2S + H2SO4(Ũ) ��4S�� +4H2O
��ʪ��ĺ�ɫʯ����ֽ������Ϊ��ɫ��պ��Ũ����IJ������������ְ��̡�
��������
�����������1����FeCl3ˮ���������������������ܹ���ˮ����Ӧ�ķ���ʽΪFe3++3H2O![]() Fe(OH)3+3H+��FeCl3 �����������ܹ���ʴ�������ӷ���ʽΪ2Fe3++ Fe��3Fe2+���ʴ�Ϊ��Fe3++3H2O
Fe(OH)3+3H+��FeCl3 �����������ܹ���ʴ�������ӷ���ʽΪ2Fe3++ Fe��3Fe2+���ʴ�Ϊ��Fe3++3H2O![]() Fe(OH)3+3H+��2Fe3++ Fe��3Fe2+��
Fe(OH)3+3H+��2Fe3++ Fe��3Fe2+��
��NaClO3 ��������Һ������FeCl2����Ӧ����Ԫ�صĻ��ϼ���+5�۽���Ϊ-1������Ԫ�صĻ��ϼ���+2�����ߵ�+3�������ݻ��ϼ������غ���ƽ��1ClO3-+6Fe2++6H+��1Cl-+ 6Fe3++3H2O���ʴ�Ϊ��1ClO3-+6Fe2++6H+��1Cl-+ 6Fe3++3H2O��
��2���������ữ��MnO2����I�����ɵⵥ������Ӧ�����ӷ���ʽΪMnO2+4H++2I-��Mn2++I2+2H2O���ʴ�Ϊ��MnO2+4H++2I-��Mn2++I2+2H2O��
��3��D��Է���������C��Է���������16,˵��D���Ӻ�C�������һ����ԭ�ӣ�D��Z��Ӧ����E��E���ᣬ˵��E�Ǻ����A��һ�����Σ���X ������ǿ�ỹ��ǿ��ʱ���ܷ����������仯,˵��A�����(NH4)2S��
��XΪǿ��ʱ,BΪ����,YΪ����O2,CΪһ������NO,DΪ��������NO2,ZΪˮH2O,EΪ����HNO3,
��X��ǿ��ʱ,X��Ϊ����HCl��������������,��Ϊ��±��û��ǿ������,���ܽ�(NH4)2S����,�����ܷ�������ת����BΪ����H2S,YΪ����O2,CΪ��������SO2,DΪ��������SO3,ZΪˮH2O,EΪ����H2SO4��
�ٵ�X��ǿ��ʱ��B����C�Ļ�ѧ����ʽΪ2H2S+3O2=2SO2+2H2O���ʴ�Ϊ��2H2S+3O2=2SO2+2H2O��
�ڵ�X��ǿ��ʱ��Ũ��E��Һ�������B��Ӧ�Ļ�ѧ����ʽΪH2S + H2SO4(Ũ) ��4S�� +4H2O���ʴ�Ϊ��H2S + H2SO4(Ũ) ��4S�� +4H2O��
�۵�X��ǿ��ʱ������B����IJ�������������Ϊʪ��ĺ�ɫʯ����ֽ������Ϊ��ɫ��պ��Ũ����IJ������������ְ������ʴ�Ϊ��ʪ��ĺ�ɫʯ����ֽ������Ϊ��ɫ��պ��Ũ����IJ������������ְ��̡�

 �ο�����������100��ϵ�д�
�ο�����������100��ϵ�д� �Űٷֿ�ʱ����ϵ�д�
�Űٷֿ�ʱ����ϵ�д�����Ŀ����1���о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣 ��֪��
2SO2(g)+O2(g) 2SO3(g) ��H= -196.6kJ��mol��1
2NO(g)+O2(g)![]() 2NO2(g) ��H= -113.0kJ��mol-1
2NO2(g) ��H= -113.0kJ��mol-1
��ӦNO2(g)+SO2(g)![]() SO3(g)+NO(g)����H= kJ��mol-1
SO3(g)+NO(g)����H= kJ��mol-1
��2�����Ƕ�ֲ����������ȱ�ٵ�Ԫ�أ��ϳɰ��ķ�Ӧ����������ʳ�����Ӧ���£�
N2(g)��3H2(g)![]() 2NH3(g)��
2NH3(g)��
��һ�������£���һ������N2��H2�Ļ���������ij�����ܱ������У�һ��ʱ�������������˵���÷�Ӧ�ﵽƽ��״̬���� ������ţ���
A�������л��������ܶȲ���ʱ��仯 |
B������3 mol H-H����ͬʱ�γ�6 mol N-H�� |
C��N2��H2��NH3�����ʵ���֮��Ϊ1:3:2 |
D�������е�ѹǿ����ʱ��仯 |
��3����25 ����101 kPa�£�1 g�״�ȼ������CO2��Һ̬ˮʱ����22.68 kJ����÷�Ӧ���Ȼ�ѧ����ʽ��____________��