题目内容
某科研小组用高岭土(主要成分是Al2O3·2SiO2·2H2O,并含少量的CaO、Fe2O3)研制新型净水剂(铝的化合物)。其实验步骤如下:将土样和纯碱混匀,加热熔融,冷却后用水浸取熔块,过滤,弃去残渣,溶液用盐酸酸化,经过滤,分别得到沉淀和溶液,溶液即为净水剂。
(1)写出熔融时的主要成分与纯碱反应的化学方程式(Al2O3与纯碱的反应和SiO2与纯碱反应相似):________________________,
(2)最后的沉淀物是__________________________________,
写出生成该沉淀的离子方程式:_______________________________
(3)实验中常用的有瓷坩埚、氧化铝坩埚和铁坩埚。本实验在熔融土样时,应选________坩埚。

【解析】土样成分中的CaO、Fe2O3属于碱性氧化物,不与Na2CO3反应。SiO2和Na2CO3在高温下的反应与生产玻璃的反应相同。Al2O3属于两性氧化物,与Na2CO3反应时表现酸性氧化物的性质,生成NaAlO2和CO2。
熔块加水后过滤所得的滤液中含有Na2SiO3和NaAlO2,再加入盐酸时,发生如下反应:
H++AlO +H2O===Al(OH)3↓
+H2O===Al(OH)3↓
Al(OH)3+3H+===Al3++3H2O
2H++SiO ===H2SiO3↓
===H2SiO3↓
所以,最后的沉淀物只有H2SiO3,没有Al(OH)3。
瓷坩埚中含有的SiO2及氧化铝坩埚中的Al2O3在高温下都能与Na2CO3反应, 所以熔融土样时不能使用瓷坩埚和氧化铝坩埚,只能选用铁坩埚

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(8分).某科研小组用高岭土(主要成分是Al2O3·2SiO2·2H2O,并含少量CaO、Fe2O3)研制新型净水剂(铝的化合物)。试验流程如下:
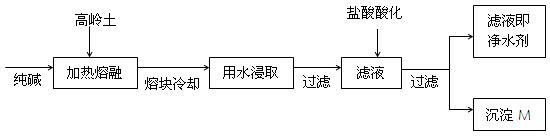
请回答下列问题:
(1)已知Al2O3、SiO2与纯碱的反应相似。用化学方程式表示熔融时高岭土主要成分与纯碱发生反应的化学方程式 、
。
(2)在熔融高岭土与纯碱试样时,最好选用下列哪种仪器 (填写编号)
| A.铁坩埚 | B.瓷坩埚 | C.氧化铝坩埚 | D.玻璃坩埚 |

