题目内容
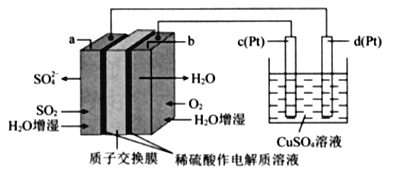
【题目】如图所示3套实验装置,分别回答下列问题。

(1)装置1为铁的吸氧腐蚀实验。向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应式为___________________。
(2)装置2中左池为氯化铁溶液,右池为硫酸铜溶液,一段时间后右池溶液中c(Cu2+)_________(填“增大”、“减小”或“不变”),若该装置的盐桥中盛装的是NH4NO3的琼脂溶液,则盐桥中的_____离子(填“NH4+”或“NO3-”)向氯化铁溶液迁移。
(3)装置3中甲烧杯盛放100mL 0.2mol/L的NaCl溶液,乙烧杯盛放100mL 0.5mol/L的CuSO4溶液。反应一段时间后,观察到乙烧杯的石墨电极上有气泡生成。
①电源的M端为___极;甲烧杯中铁电极的电极反应式为_______________。
②乙烧杯中电解反应的离子方程式为__________________________________。
③停止电解,取出Cu电极,洗涤、干燥、称量,电极增重0.32g,甲烧杯中产生的气体标准状况下体积为________mL;电解后乙烧杯溶液的pH为______(假设电解前后溶液的体积不变)。
④若要将乙池设计成电解精炼铜的装置,则乙池的石墨应改成_____(填“粗铜”或“精铜”)。
【答案】O2+4e-+2H2O═4OH- 增大 NH4+ 正 Fe-2e-═Fe2+ 2Cu2++2H2O![]() 2Cu+O2↑+4H+ 112 1 粗铜
2Cu+O2↑+4H+ 112 1 粗铜
【解析】
(1)电解质溶液中滴有酚酞,反应一段时间后,碳棒附近溶液变红,说明碳棒附近产生OH-,即碳棒电极反应式为O2+2H2O+4e-=4OH-;
(2)电池总反应是Cu+2Fe3+=2Fe2++Cu2+,即Cu电极为负极,反应式为Cu-2e-=Cu2+,右池中c(Cu2+)增大;石墨为正极,根据原电池的工作原理,NH4+向FeCl3溶液迁移;
(3)①乙烧杯石墨电极上有气泡产生,电极反应式为4OH--4e-=O2↑+2H2O,即石墨为阳极,Cu为阴极,根据电解原理,N为电源的负极,M为电源的正极;Fe电极与M相连,即Fe电极为阳极,根据电解池放电顺序,Fe失电子,电极反应式为Fe-2e-=Fe2+;
②乙烧杯电解是CuSO4水溶液,总电极反应式为2Cu2++2H2O![]() 2Cu+O2↑+4H+;
2Cu+O2↑+4H+;
③Cu电极增重0.32g,增重的是析出Cu的质量,即整个电路转移电子物质的量为0.32×2/64mol=0.01mol,甲池中石墨电极反应式为2H++2e-=H2↑,标准状况下,产生氢气的体积为0.01×22.4/2L=0.112L,即112mL;根据②,产生n(H+)=2×0.32/64mol=0.01mol,即c(H+)=0.01/(100×10-3)mol·L-1=0.1mol·L-1,pH=1;
④精炼铜时,粗铜为阳极,阴极为纯铜,故乙池的石墨应改为粗铜。

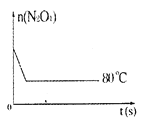
【题目】在80℃时,0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中发生如下反应:N2O4![]() 2NO2-Q,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2-Q,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s)n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) | 0.40 | a | 0.20 | c | d | e |
n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20s—40s内用N2O4表示的平均反应速率为____。
(2)该反应的平衡常数K=___。
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色___(填“变浅”、“变深”或“不变”)。
(4)要增大该反应的K值,可采取的措施有(填序号)___,若要重新达到平衡时,使[NO2]/[N2O4]值变小,可采取的措施有(填序号)___。
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线。____
【题目】能源、环境与生产生活和社会发展密切相关。
(1)工业上利用CO和H2在催化剂作用下合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) ,已知反应中有关物质的化学键键能数据如下表所示:
CH3OH(g) ,已知反应中有关物质的化学键键能数据如下表所示:
化学键 | H—H | C—O | C≡O | H—O | C—H |
E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
则 CO(g)+2H2(g) ![]() CH3OH(g) △H=__________kJmol-1
CH3OH(g) △H=__________kJmol-1
(2)以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池。如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。

B极为电池______极,B极的电极反应式为_________________________________。
(3)参考合成反应CO(g)+2H2(g) ![]() CH3OH(g)的平衡常数,回答下列问题:
CH3OH(g)的平衡常数,回答下列问题:
温度/℃ | 0 | 50 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 100 | 13 | 1.9×10-2 | 2.4×10-4 | 1×10-5 |
①该反应正反应是 ___________(填“放热”或“吸热”)反应;
②在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO转化率为50%,则T=__________℃。
(4)CH3OH也可由CO2和H2合成。在体积为1L的密闭容器中,充入lmolCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH= — 49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH= — 49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。
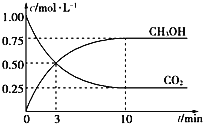
①该反应的平衡常数表达式为K=_______;从反应开始到10min,v(H2)=_____mol/(L·min);
②下列情况能说明该反应一定达到平衡状态的是___________(填字母)
A.v(CO2)消耗 = v(CH3OH)生成
B.气体的密度不再随时间改变
C.CO2和CH3OH的浓度之比不再随时间改变
D.气体的平均相对分子质量不再随时间改变
③为了加快化学反应速率且使体系中气体的物质的量增大,只改变下列某一条件,可采取的措施有__ (填字母)
A.升高温度 B.缩小容器体积
C.再充入CO2气体 D.使用合适的催化剂
④相同温度下,在另一个容积为1 L的密闭容器中充入2mol CH3OH(g)和2molH2O(g),达到平衡时CO2的浓度_______(填“>”、“ <”或“=”)0.25mol/L。