题目内容
 研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:
研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:(1)生产水煤气过程中有以下反应:
①C(s)+CO2(g)?2CO(g)△H1;
②CO(g)+H2O(g)?H2(g)+CO2(g)△H2;
③C(s)+H2O(g)?CO(g)+H2(g)△H3;
若平衡表达式为K=
| c(H2)?c(CO) |
| c(H2O) |
△H2、△H3之间的关系为
(2)不同温度下反应②的平衡常数如下表所示.则△H2
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
分析:(1)根据方程式之间的关系结合盖斯定律确定焓变关系;
(2)升高温度,平衡向吸热反应方向移动,根据移动方向和平衡常数的关系判断反应热;
根据平衡常数计算反应的CO的物质的量浓度,再结合转化率公式计算一氧化碳的转化率;
(3)根据温度、压强对该反应的影响分析,化学平衡常数只与温度有关.
(2)升高温度,平衡向吸热反应方向移动,根据移动方向和平衡常数的关系判断反应热;
根据平衡常数计算反应的CO的物质的量浓度,再结合转化率公式计算一氧化碳的转化率;
(3)根据温度、压强对该反应的影响分析,化学平衡常数只与温度有关.
解答:解:(1)根据平衡表达式为K=
知,生成物中含有氢气、一氧化碳两种气体,反应物中含有水蒸气,则符合条件的只有③,所以该反应是③;
将方程式①+②得③,所以其焓变得△H1+△H2═△H3(或△H2═△H3-△H1,或△H1═△H3-△H2,
故答案为:③;△H1+△H2═△H3(或△H2═△H3-△H1,或△H1═△H3-△H2;
(2)根据表中数据知,升高温度,化学平衡常数减小,说明平衡向逆反应方向移动,则正反应是放热反应,△H2<0,根据反应方程式中各物质的关系式知,平衡时,c(CO)=0.005mol/L、c(H2)=0.015mo/L,
参加反应的c(CO)=c(H2)=0.015mo/L,一氧化碳的转化率=
×100%=75%,
故答案为:<;75%;
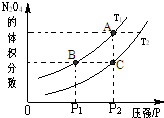
(3)该反应的正反应是放热反应,相同压强下,由C到A,四氧化二氮的体积分数增大,平衡向正反应方向移动,说明温度降低,则T1<T2;该反应的正反应是气体体积减小的可逆反应,增大压强,平衡向正反应方向移动,温度越高,平衡常数越小,所以B>C,
故答案为:<;正;>.
| c(H2)?c(CO) |
| c(H2O) |
将方程式①+②得③,所以其焓变得△H1+△H2═△H3(或△H2═△H3-△H1,或△H1═△H3-△H2,
故答案为:③;△H1+△H2═△H3(或△H2═△H3-△H1,或△H1═△H3-△H2;
(2)根据表中数据知,升高温度,化学平衡常数减小,说明平衡向逆反应方向移动,则正反应是放热反应,△H2<0,根据反应方程式中各物质的关系式知,平衡时,c(CO)=0.005mol/L、c(H2)=0.015mo/L,
参加反应的c(CO)=c(H2)=0.015mo/L,一氧化碳的转化率=
| 0.015mol/L |
| 0.005mol/L+0.015mol/L |
故答案为:<;75%;
(3)该反应的正反应是放热反应,相同压强下,由C到A,四氧化二氮的体积分数增大,平衡向正反应方向移动,说明温度降低,则T1<T2;该反应的正反应是气体体积减小的可逆反应,增大压强,平衡向正反应方向移动,温度越高,平衡常数越小,所以B>C,
故答案为:<;正;>.
点评:本题考查了外界条件对化学平衡移动的影响、盖斯定律等知识点,这些知识点都是考试热点,会根据反应方程式特点及外界条件来分析解答,难度中等.

练习册系列答案
相关题目