题目内容
已知两种物质发生化学反应的微观示意图如图(一种小球代表一种原子,原子间的短线代表原子的结合),下列说法正确的是( )


| A、图示中共有3种分子 |
| B、说明化学反应中原子不可分 |
| C、该图示不符合质量守恒定律 |
| D、该反应属于置换反应 |
考点:甲烷的化学性质
专题:有机反应
分析:A.依据物质的球棍模型判断物质的分子种数;
B.依据反应前后原子种类没有变化解答;
C.根据原子的种类及数目的变化分析该图示是否符合符合质量守恒定律;
D.置换反应是指:单质+化合物=新单质+新化合物据此解答.
B.依据反应前后原子种类没有变化解答;
C.根据原子的种类及数目的变化分析该图示是否符合符合质量守恒定律;
D.置换反应是指:单质+化合物=新单质+新化合物据此解答.
解答:
解:A.从反应的微观示意图可知图中共用4种不同的球棍模型,分别代表4种不同的分子,故A错误;
B.从图示可以看出,反应前后原子的种类没有发生变化,说明了在化学反应中原子不可分,故B正确;
C.从图示可以看出反应前后原子的种类、数目不变,符合质量守恒定律,故C错误;
D.图示中生成物是两种化合物,没有单质生成,该反应不属于置换反应,故D错误;
故选:B.
B.从图示可以看出,反应前后原子的种类没有发生变化,说明了在化学反应中原子不可分,故B正确;
C.从图示可以看出反应前后原子的种类、数目不变,符合质量守恒定律,故C错误;
D.图示中生成物是两种化合物,没有单质生成,该反应不属于置换反应,故D错误;
故选:B.
点评:本题为给信息题,依据所给反应的示意图及分子由原子构成、反应类型等特点,正确判断变化中的物质构成和反应类型,是解答本题的基本方法.

练习册系列答案
相关题目
如图是某水溶液在pH从0至14的范围内H2CO3、HCO3-、CO32-三种成分平衡时的组成分数.

下列叙述正确的是( )

下列叙述正确的是( )
| A、此图是1.0mol?L-1碳酸钠溶液滴定1.0 mol?L-1?HCl溶液的滴定曲线 |
| B、在pH分别为6.37及10.25时,溶液中c(H2CO3)=c(HCO3-)=c(CO32-) |
| C、人体血液的pH约为7.4,则CO2在血液中多以HCO-3形式存在 |
| D、若用CO2和NaOH反应制取NaHCO3,应控制溶液的pH偏大或偏小 |
下列说法正确的是( )
| A、NaHSO3和NaHCO3的混合溶液中(S和C均用R表示):c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-) |
| B、常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2,三种溶液中水的电离程度:③>①>② |
| C、39g Na2O2与足量水反应后转移的电子数为NA(NA表示阿伏加德罗常数的值) |
| D、当6.9g Fe3O4与足量稀HNO3反应(还原产物只有NO),则参加反应的HNO3为0.28mol |
下列说法中,正确的是( )
| A、对“地沟油”进行分馏可以获得汽油发动机的燃料 |
| B、乙烯和聚乙烯都可与溴水发生加成反应 |
| C、研究表明禽流感病毒H7N9在沸水中两分钟就能被杀死,是因为蛋白质受热易变性 |
| D、乙醇和乙酸的反应与苯和液溴的反应类型不同 |
常温下,在0.005mol/L H2SO4中,水的离子积是( )
| A、1×10-14 |
| B、1×10-12 |
| C、1×10-24 |
| D、1×10-4 |
下列说法正确的是( )
| A、硅和石墨都是重要的半导体材料 |
| B、SO2、NO2、CO2都会导致酸雨的形成 |
| C、明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理不同 |
| D、氢能是清洁能源,工业上用电解水法制大量氢气符合节能减排理念 |
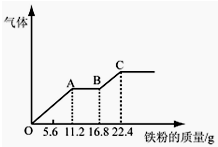 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )| A、原混合酸中NO3-物质的量浓度为2mol/L |
| B、OA段产生的是NO,AB段的反应为Fe+2Fe3+═3Fe2+,BC段产生氢气 |
| C、第二份溶液中最终溶质为FeSO4 |
| D、H2SO4浓度为2.5mol?L-1 |
 对基苯甲醛,…俗称PHBA,是-种重要的有机化工原料.其结构如图所示
对基苯甲醛,…俗称PHBA,是-种重要的有机化工原料.其结构如图所示
 Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:
Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题: