题目内容
将Na2O2与NaHCO3的均匀混合物粉末分成等质量的两份,其中一份加入100 mL盐酸使其充分反应,溶液呈中性,放出气体2.24 L(标准状况);将生成的气体通入另一份混合物中充分反应后,气体体积变为(1)混合物中Na2O2和NaHCO3的物质的量之比。
(2)加入盐酸的物质的量浓度。
(1)2:9或8:1
(2)1.3 mol·L-1或3.4 mol·L-1
解析:(1)若Na2O2在反应中未完全消耗完,设混合物中含NaHCO3的物质的量为x,消耗的CO2物质的量为y
2Na2O2+2CO2![]() 2Na2CO3+O2 Δn
2Na2CO3+O2 Δn
2 mol 1 mol 1 mol
Y ![]() =0.01 mol
=0.01 mol
则y=0.02 mol
NaHCO3+HCl![]() NaCl+CO2↑+H2O
NaCl+CO2↑+H2O
1 mol 1 mol
x 0.02 mol
则x=0.02 mol
Na2O2的物质的量为(![]() -0.02 mol)×2=(0.1 mol-0.02 mol)×2=0.16 mol
-0.02 mol)×2=(0.1 mol-0.02 mol)×2=0.16 mol
Na2O2与NaHCO3的物质的量之比为0.16 mol:0.02 mol=8:1
因为溶液里正负电荷守恒,n(Na+)=n(Cl-),所以加入盐酸的物质的量浓度为:
 =3.4 mol·L-1
=3.4 mol·L-1
(2)若Na2O2全部消耗完,设Na2O2的物质的量为x′,O2的物质的量为y′
2Na2O2+2CO2![]() 2Na2CO3+O2 Δn
2Na2CO3+O2 Δn
2 mol 2 mol 1 mol 1 mol
x′ y′ ![]() =0.01 mol
=0.01 mol
则x′=0.02 mol y′=0.01 mol
CO2的物质的量为:![]() -0.01 mol=0.1 mol-0.01 mol=0.09 mol
-0.01 mol=0.1 mol-0.01 mol=0.09 mol
n(NaHCO3)=n(CO2)=0.09 mol
Na2O2与NaHCO3的物质的量之比为0.02 mol:0.09 mol=2:9
加入盐酸的物质的量浓度为:
 =1.3 mol·L-1.
=1.3 mol·L-1.

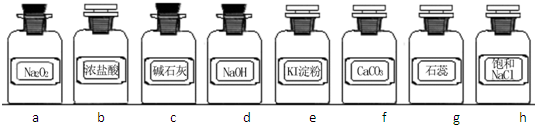
(1)写出用Na2O2与浓盐酸反应制备氯气的化学方程式:
(2)下列装置组合最合理的是
| 组合 | 制备装置 | 净化装置 | 检验装置/试剂 | 尾气处理装置 |
| A | ③ | ② | ⑦/e | ⑤ |
| B | ③ | ① | ⑧/e | ① |
| C | ④ | ① | ⑤/e | ② |
| D | ⑥ | ⑤ | ⑧/e | ① |
(4)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:①
(5)你是否同意将Na2O2与浓盐酸的反应作为实验室制备氯气的方法之一?
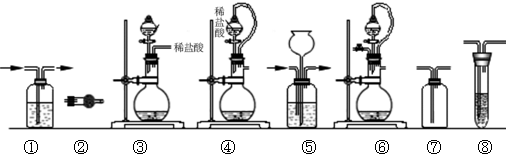
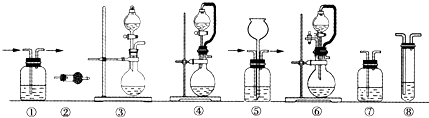
(12分)实验室常用强氧化剂(如KMnO4、KClO3、MnO2等)氧化浓盐酸的方法来制备氯气。某研究性学习小组欲探究用Na2O2与浓盐酸制备并检验氯气。供选用的实验试剂及装置如下(部分导管、蒸馏水略):


(1)写出用Na2O2与浓盐酸制备氯气的化学方程式_________________________。
(2)下列装置组合最合理的是__________ (填序号,需考虑实验结束撤除装置时残留有害气体的处理)。
|
组合 |
制备装置 |
净化装置 |
检验装置/试剂 |
尾气处理装置 |
|
A |
③ |
② |
⑦/e |
⑤ |
|
B |
③、⑥ |
① |
⑧/g |
① |
|
C |
④ |
① |
⑤/e |
② |
|
D |
④、⑥ |
⑤ |
⑧/g |
① |
(3)尾气经处理后仍有较多气体排出,其主要原因可用化学方程式表示为:____________ 。
(4)某小组成员建议用双氧水代替过氧化钠进行实验更好,请你给出两条合适的理由:
① ___________________________________,② ___________________________________。
(5)你是否同意将Na2O2与浓盐酸的反应作为实验室制备氯气的方法之一?___________(填“是”或“否”);理由是__________________________________________ 。