题目内容
【题目】NH4HSO4在水溶液中的电离方程式为:NH4HSO4=NH4++H++SO42﹣.现向100mL 0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示.下列说法中不正确的是
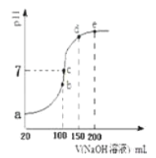
A.a点的溶液中:c(SO42﹣)>c(NH4+)>c(H+)>c(Na+)>c(OH﹣)
B.b点的溶液中:c(Na+)=c(SO42﹣)>c(H+)>c(NH4+)>c(OH﹣)
C.c点的溶液中:c(Na+)>c(SO42﹣)>c(NH4+)>c(OH﹣)=c(H+)
D.d、e点对应溶液中,水电离程度大小关系是d>e
【答案】B
【解析】
A.a点的溶液中,100mL 0.1mol/LNH4HSO4溶液中滴加0.1mol/LNaOH溶液为20mL,NH4HSO4过量,剩余的NH4HSO4大约是Na+的4倍,已知NH4HSO4=NH4++H++SO42-,所以c(SO42-)>c(NH4+)>c(H+)>c(Na+)>c(OH-),故A正确;
B.b点NaOH为100mL,NH4HSO4与NaOH等物质的量反应生成等浓度的(NH4)2SO4和Na2SO4,溶液显弱酸性,由于Na+、SO42-都不水解,所以c(Na+)=c(SO42-),NH4+水解显酸性,水解程度较小,所以c(NH4+)>c(H+),则溶液中离子浓度关系为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-),故B错误;
C.c点的溶液pH=7,NaOH稍微过量,则c(Na+)>c(SO42-),溶液中c(OH-)=c(H+),所以溶液中离子浓度关系为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故C正确;
D.d、e点对应溶液中,氨水过量,溶液显碱性,氨水电离的氢氧根离子抑制了水的电离,氢氧根离子浓度越大,水的电离程度越小,由图可知,e点溶液中氢氧根离子浓度大,则水的电离程度小,即水电离程度大小关系是d>e,故D正确;
故选B。

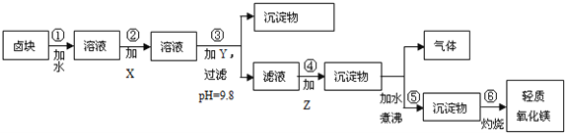
【题目】已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO2、CaO等)制备草酸镍晶体的流程如图所示:

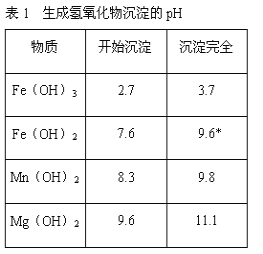
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10;
③当某物质浓度小于1.0×10-5 mol·L-1时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:_______________________________。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式:_____________。
(3)“调pH”时pH的调控范围为__________________。
(4)写出“沉镍”时发生反应的离子方程式:________________________________,证明Ni2+已经沉淀完全的实验步骤及现象是______________________________,当Ca2+沉淀完全时,溶液中c(F-)>____________mol·L-1(写出计算式即可)。
【题目】下表中各粒子、粒子对应的立体构型及解释均正确的是( )
选项 | 粒子 | 立体构型 | 解释 |
A | 氨基负离子(NH2—) | 直线形 | N原子采用sp杂化 |
B | 二氧化硫(SO2) | V形 | S原子采用sp3杂化 |
C | 碳酸根离子(CO32—) | 三角锥形 | C原子采用sp3杂化 |
D | 碘三正离子(I3+) | V形 | I原子采用sp3杂化 |
A.AB.BC.CD.D